IVD一周热点回顾



一周热点资讯
01 事件:
基蛋生物投资1.5亿建设现代化智能化生产研发基地
“华支睾吸虫核酸试剂盒”成果转化签约
国务院副总理到IVD公司调研
北京协和医院设立跨科室院级总技师长岗位
迈瑞与国家自然科学基金委员会签约,共建民营企业创新发展联合基金
02 政策:
中方对欧盟进口医疗器械采取相关措施
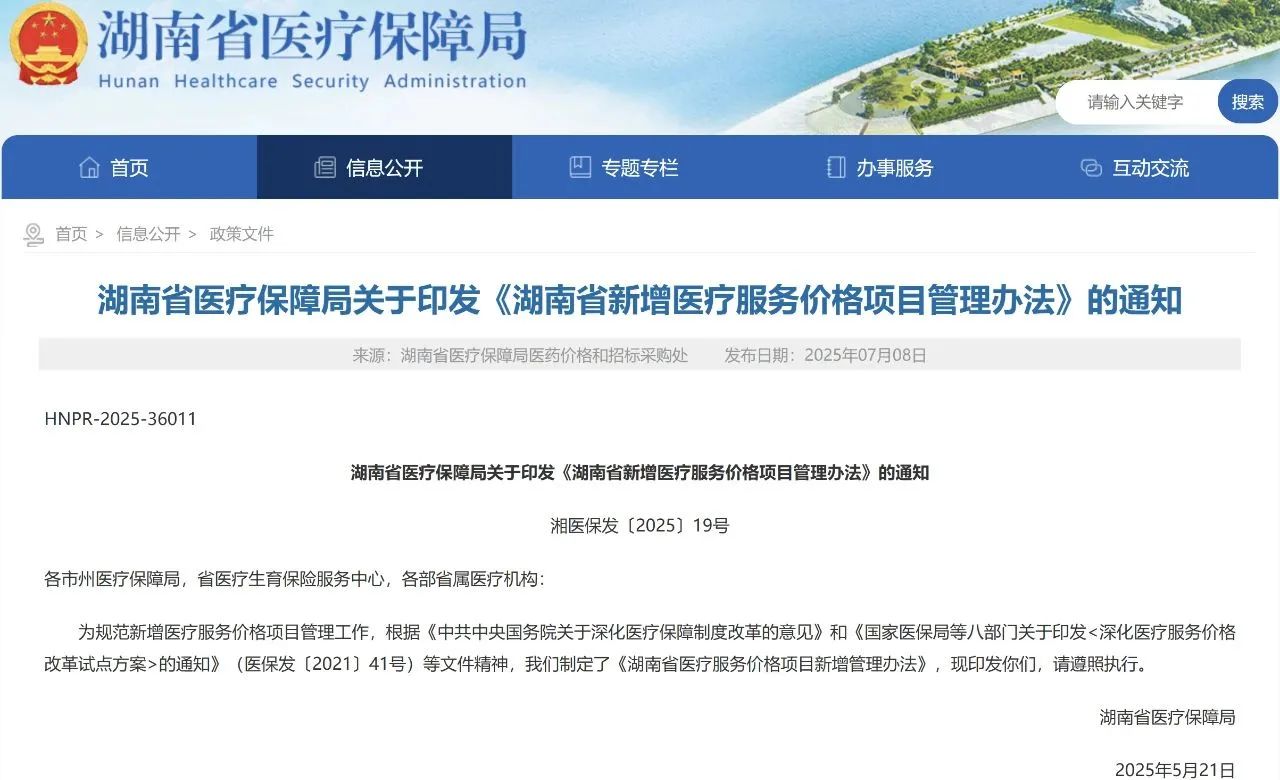
湖南省医保局发布《新增医疗服务价格项目管理办法》
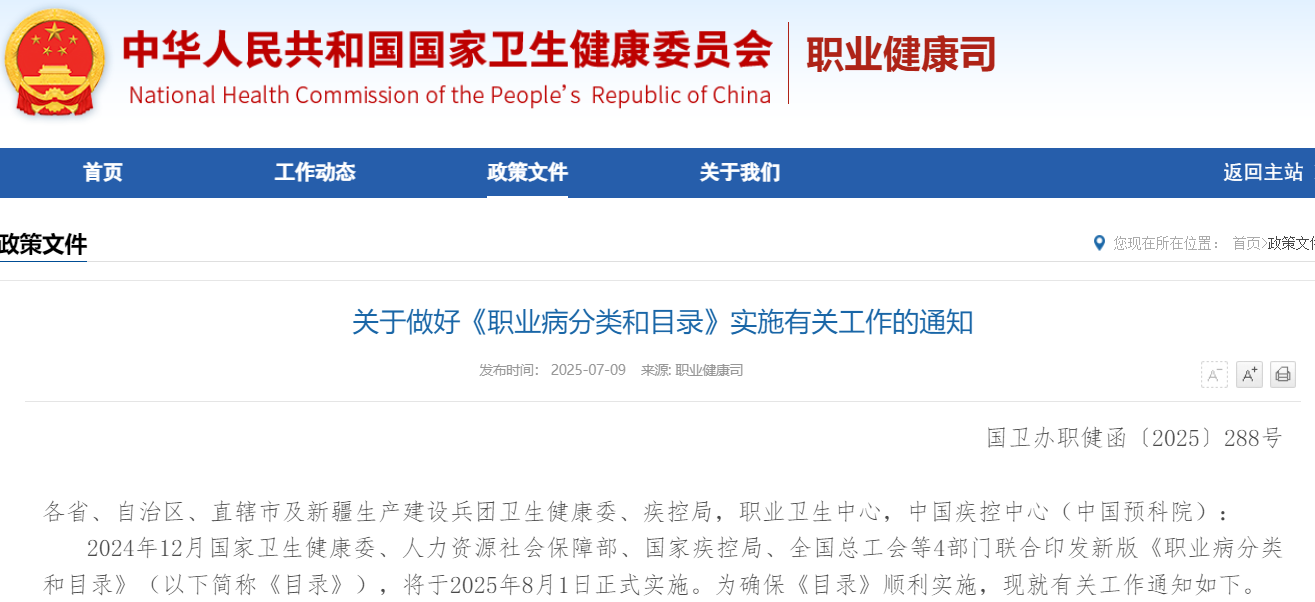
2025年8月1日起施行的《职业病分类和目录》明确省级卫健部门需在2025年底前完成诊断能力建设
上海、江苏、浙江、安徽省卫生健康委员会联合发布《长三角区域卫生健康一体化发展三年行动计划(2025-2027年)》
03 新产品/技术:
国内首家,肝素结合蛋白(HBP)检测试剂盒(核酸适体化学发光法)获批上市
金域医学又一新研究发布
国内首个本土多标志物AD试剂盒进入优先通道
英诺特以“纯中国身份“拿下FDA甲乙流注册证
新产业获得新专利
04 融资动态:
浙江数问生物宣布完成近亿元C1轮融资
苏州中析生物信息有限公司宣布完成近亿元A轮融资
1、基蛋生物投资1.5亿建设现代化智能化生产研发基地
3、国务院副总理到IVD公司调研

1、中方对欧盟进口医疗器械采取相关措施

1、国内首家,肝素结合蛋白(HBP)检测试剂盒(核酸适体化学发光法)获批上市



赞
收藏




发表评论 取消回复