本期分享新南威尔士大学邓飞教授报告:《基于CRISPR的自催化生物传感器精准诊断技术》。



2025年8月2日,由中国医药生物技术协会生物诊断技术分会主办,第二期生物诊断前沿技术专题会在江苏省无锡市惠山生命科技园召开。专题会聚焦CRISPR免扩增与非核酸检测技术。
生物诊断公众号将对各专家汇报内容进行汇编整理,供关注CRISPR诊断技术的业内同仁学习参考。
本期分享新南威尔士大学邓飞教授报告:《基于CRISPR的自催化生物传感器精准诊断技术》。

以下为邓飞教授的部分报告内容:
注:报告由生物诊断平台整理汇编,内容仅供学习参考。
基于CRISPR的自催化生物传感器精准诊断技术

在向导RNA的引导下,CRISPR系统能够特异性识别目标序列并进行精确切割。以Cas12为例,当系统识别靶标DNA后,会启动具有多重转化效率的反式切割功能,能够切割数千个信号分子,从而实现信号放大。
近年来,基于CRISPR的诊断技术领域持续扩展,相关研究成果不断涌现。
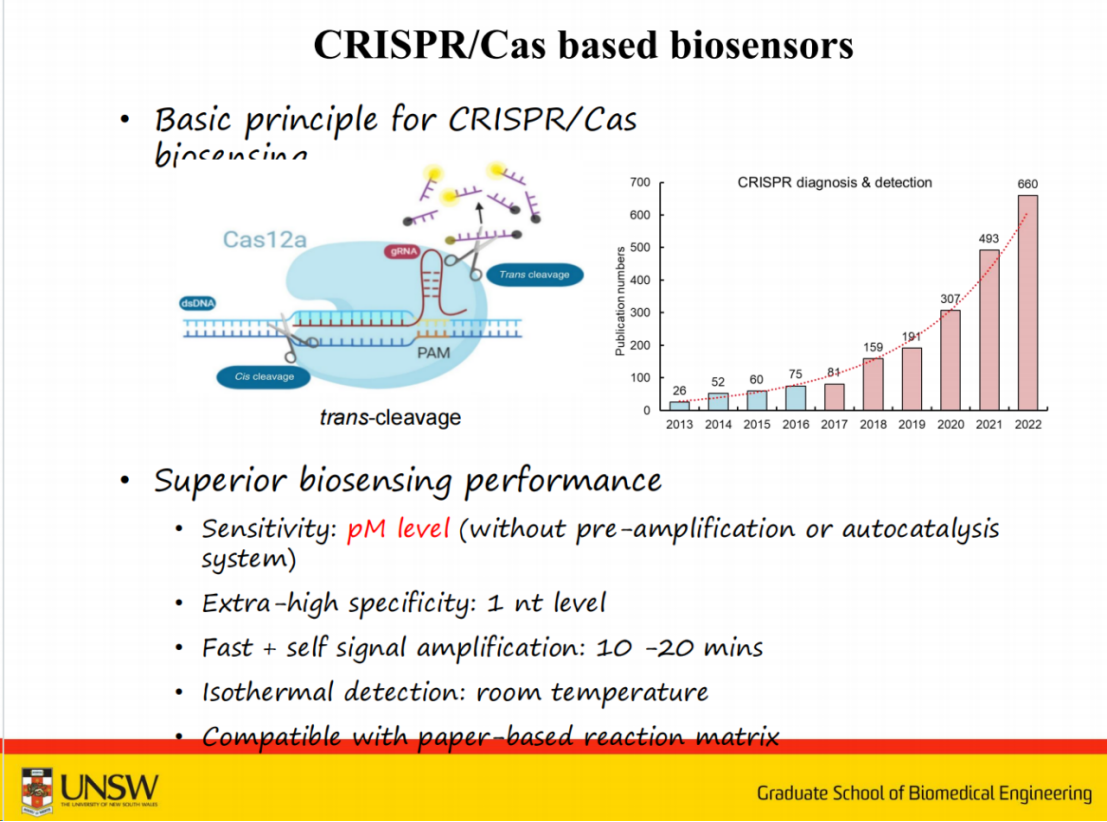
目前,单独使用CRISPR系统可实现pMol级检测灵敏度,在优化条件下可达fMol级别。
若结合PCR、RPA或LAMP等预扩增技术,则可轻松达到aMol甚至更低的检测限。
此外,该系统具备单碱基分辨能力,这对SNP检测和癌症诊断具有重要意义。
另一个显著优势是其检测时间仅需10-20分钟,且可在室温条件下完成,这使其非常适合用于即时检测(POCT)。
该系统还可与微流控器件或纸质试纸条等技术结合,开发POCT检测设备。
1、原理
然而,单独使用CRISPR技术(不结合预扩增方法)的检测限通常只能达到pMol至fMol级别,难以满足临床检测中1拷贝/微升的要求。
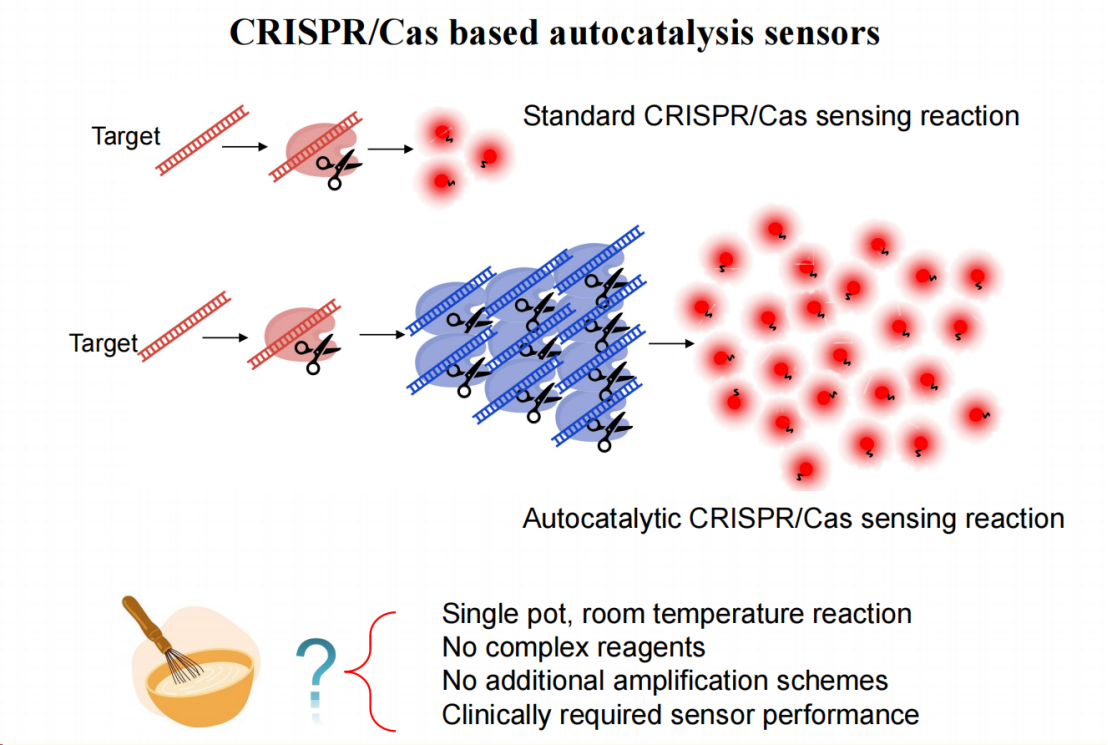
为解决这一问题,我们设计了一种级联反应机制。
在常规CRISPR系统中,单个靶标可激活一个Cas RNP复合物,进而切割数千至上万个信号分子实现信号放大。
我们的创新之处在于引入环状中介分子,使得单个靶标激活的Cas RNP可通过该中介分子进一步激活数千个Cas RNP,从而实现多级信号放大。这一设计避免了传统预扩增方法的使用。
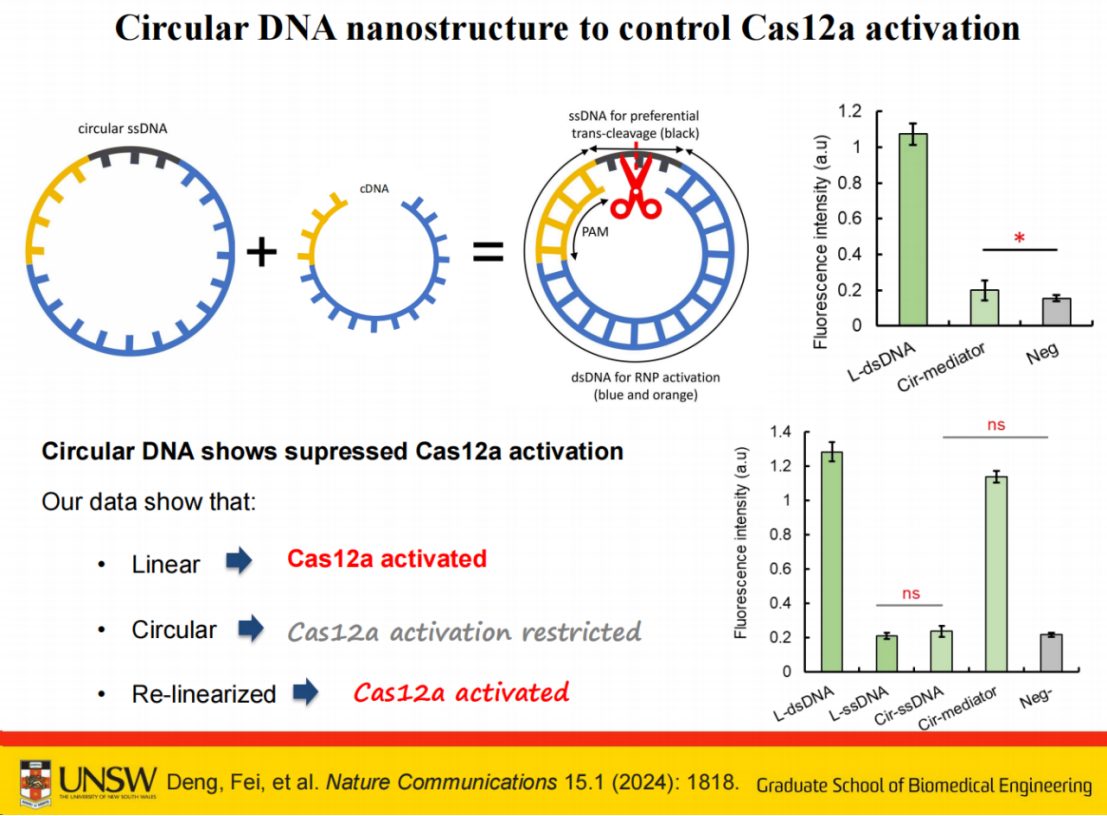
具体来说,我们特别设计了一种环状DNA作为中介分子。
该分子包含两个功能区域:一段连接序列(linker)和一段模拟触发序列(fake trigger)。当连接序列与fake trigger形成环状分子后,由于环状结构的存在,该分子不会直接激活CRISPR系统。只有当连接序列被剪切后,才会释放出模拟触发序列。
当Cas12a RNP识别靶标被激活后,首先剪切环状单链DNA片段,释放的双链DNA片段可进一步激活其他Cas12a蛋白,形成自催化循环反应。
理论上,单个靶标即可激活系统中所有Cas12a RNP,最终实现信号放大。
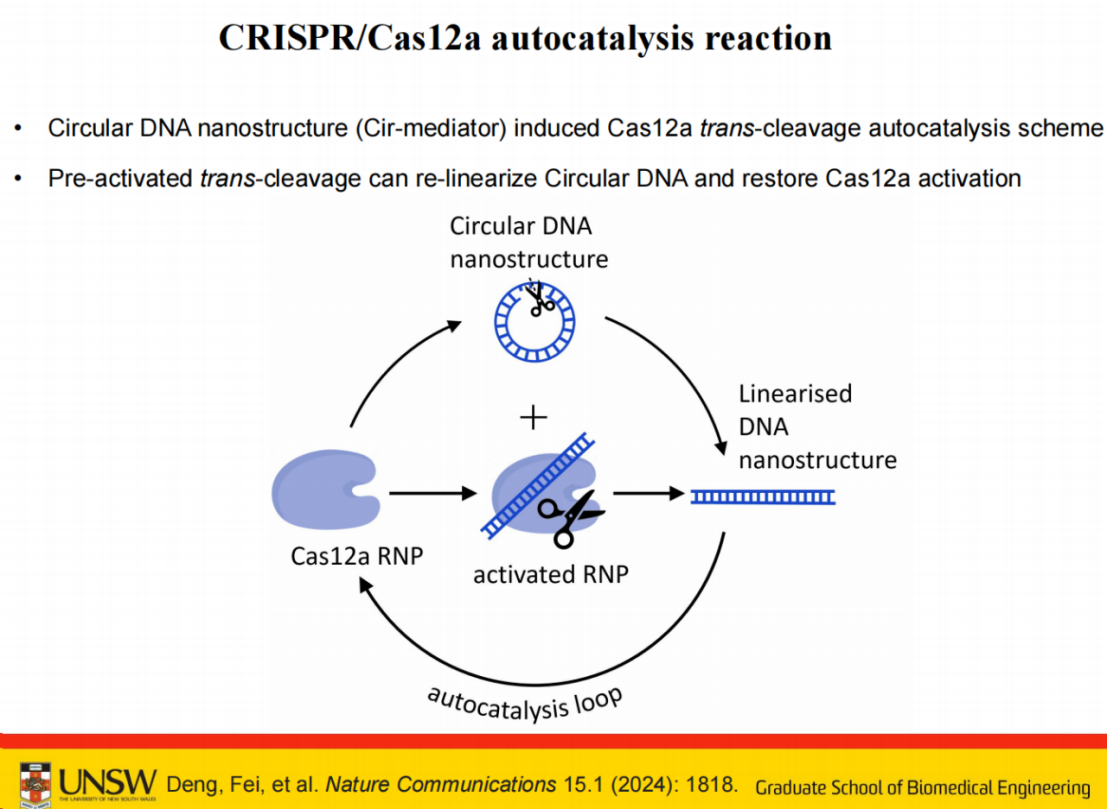
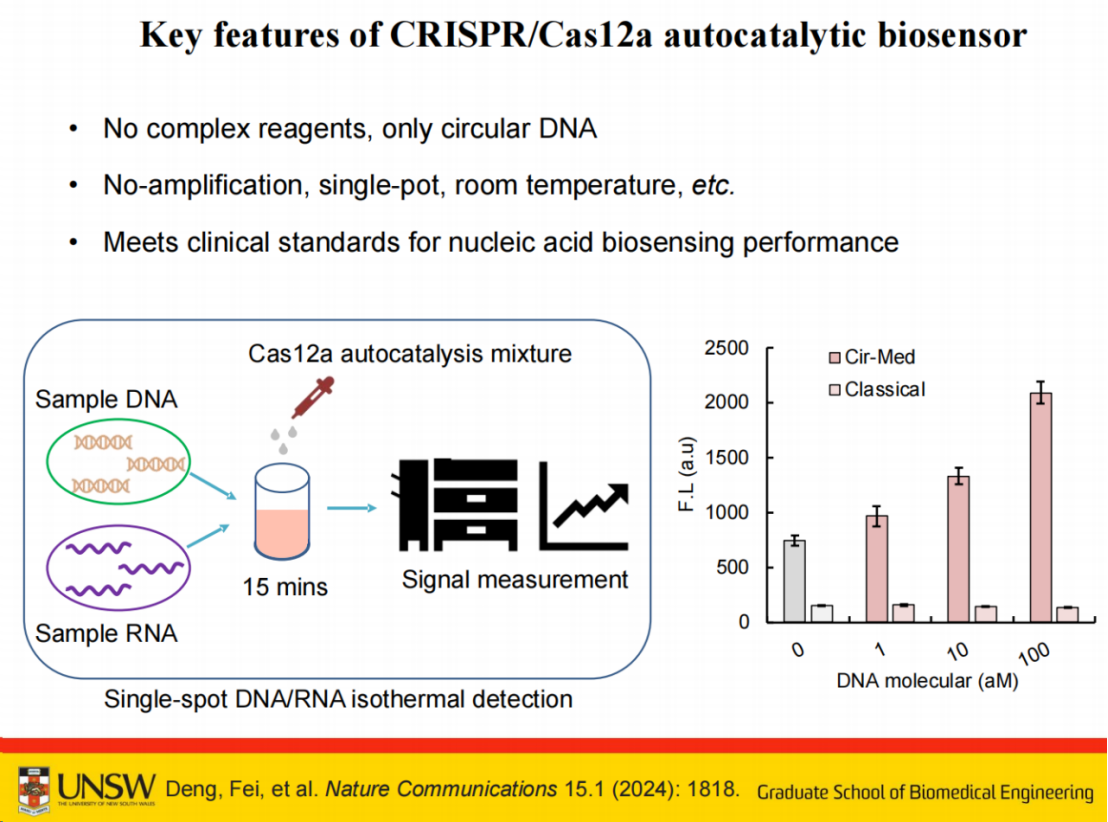
基于该原理构建的检测系统,以样本DNA或RNA为检测对象,可实现室温条件下,15分钟完成无需PCR扩增的一锅法检测。
2、应用
在验证实验中,该系统成功实现了对幽门螺杆菌 1拷贝/微升的检测灵敏度。
在新冠病毒RNA检测方面,尽管Cas12a系统对RNA的检测效率相较于DNA有所降低,但通过适当提高CRISPR反应试剂或探针的浓度,仍可实现单拷贝级别的检测。
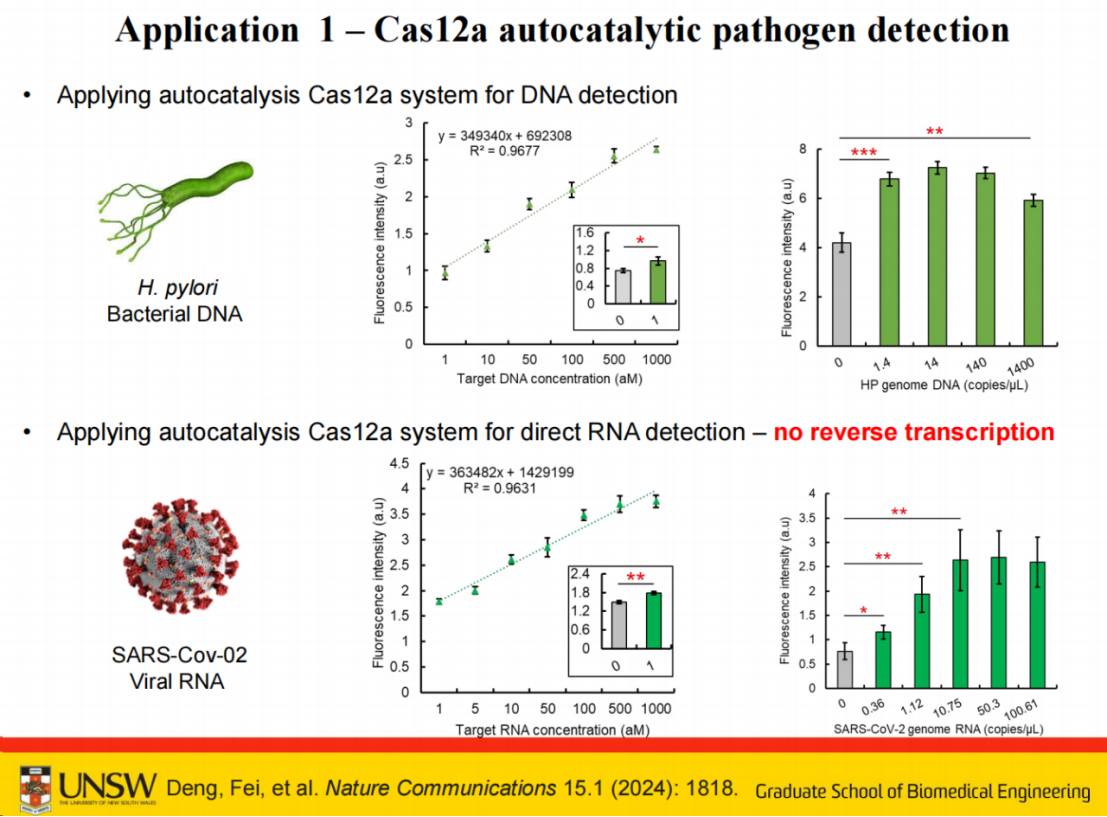
此外,我们利用结直肠癌小鼠模型进行实验,通过加入10微升血清样本与90微升CRISPR反应混合物混合,反应15分钟后即可观察到明显的信号差异。
相较于传统CRISPR系统,我们的自催化传感反应系统能够有效区分正常样本、癌症样本以及治疗后样本,而传统方法在amol或fmol级别的检测中难以实现这种区分。
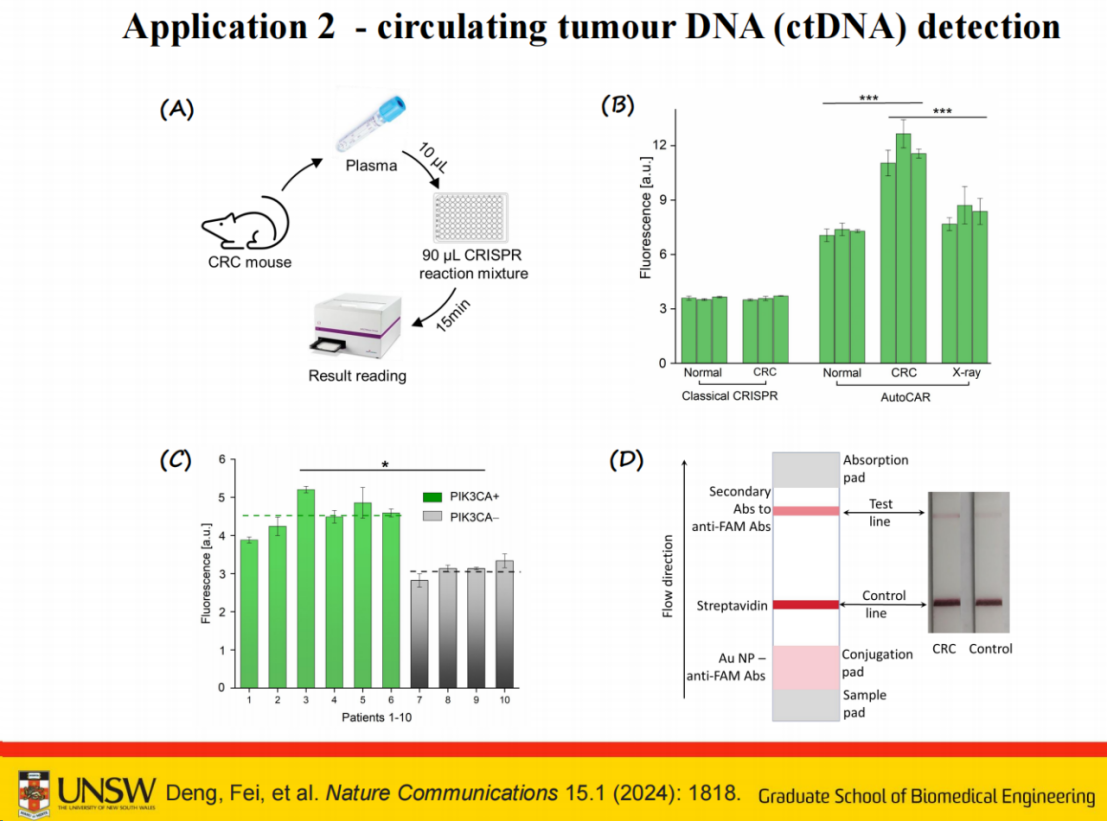
进一步地,我们获取了临床患者血液样本,针对PIK3CA基因的单碱基变异进行检测。实验结果表明,该系统能够有效区分突变型与野生型样本。
然而,在癌症早期检测中需注意,患者血清中突变DNA的比例通常极低,可能低于1%甚至0.1%。由于CRISPR系统源自细菌的免疫防御机制,其设计初衷决定了即使靶序列存在单碱基变异,仍可能激活系统,只是效率相对完全匹配的序列有所降低。
为提升检测的实用性,我们结合侧向层析技术(lateral flow),进一步验证了该系统在癌症早期检测中的可行性。通过优化反应条件并整合多种检测手段,该方法为高灵敏度、高特异性的核酸诊断提供了新的技术路径。
1、基本原理与优化
与Cas12系统类似,我们将该方法拓展应用于Cas13系统,主要用于RNA检测领域。
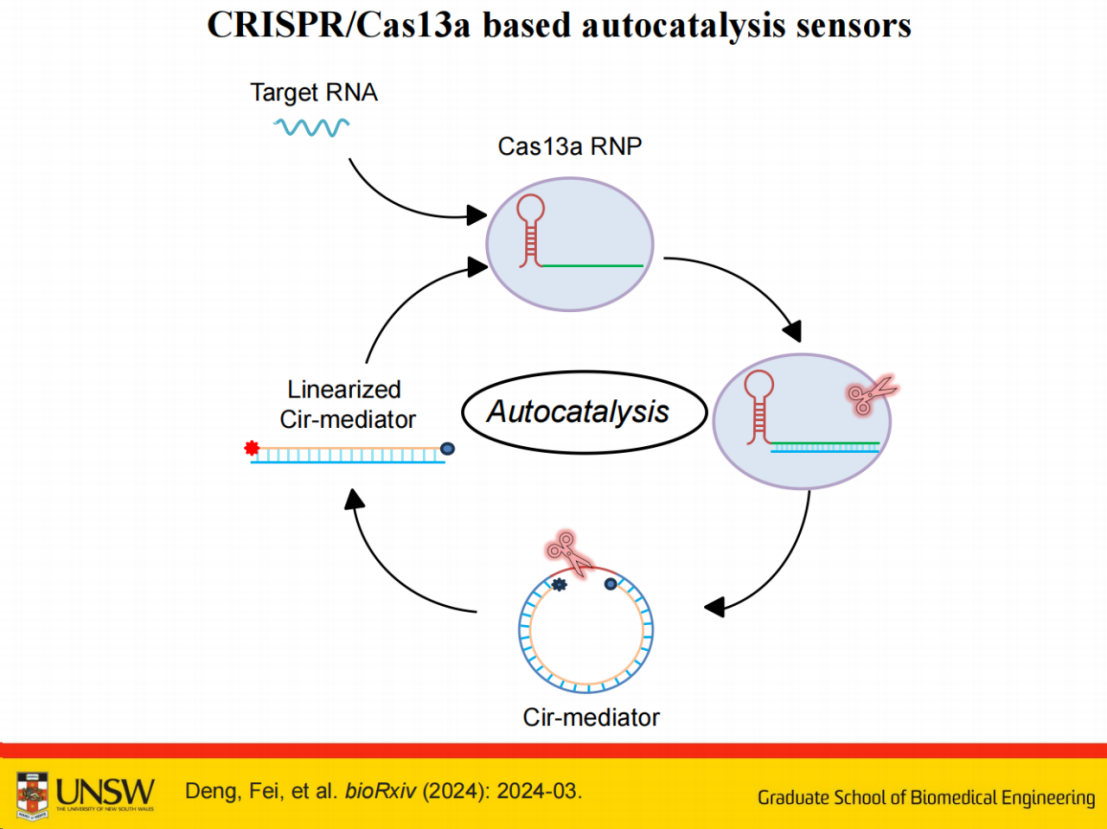
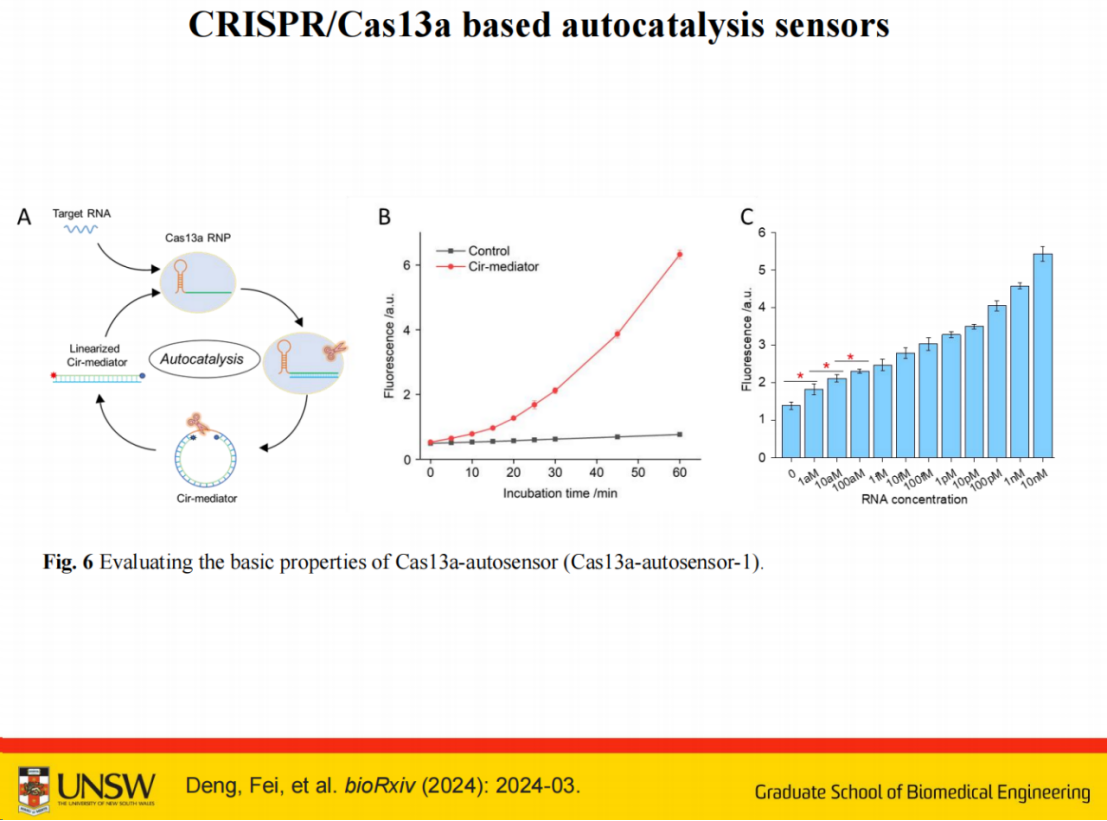
该系统的核心机制与Cas12系统类似:首先靶向目标RNA并激活Cas13a,随后被激活的Cas13a可切割环状介体(cir-mediator),生成线性化介体,并进一步激活下一个Cas13a,从而实现自催化传感反应。
为进一步简化系统设计,我们引入了整合荧光基团和猝灭基团的探针,将报告系统功能直接融合其中。
该探针基于荧光共振能量转移(FRET)原理:当荧光基团与猝灭基团间距为5个碱基时处于猝灭状态;当被Cas酶剪切后,释放片段的间距拉长至约20个碱基,荧光信号完全恢复。基于此原理开发的环状介体不仅实现了反应的自驱动放大(自催化),还整合了报告功能,使整个系统达到最小复杂度。
(1) 不同RNA类型对系统的激活效果
在实验验证阶段,我们测试了不同RNA类型对系统的激活效果。
结果显示:
单链RNA(ssRNA)对Cas13的激活效果最佳。
当对ssRNA进行磷酸硫酰化修饰(PS modification)后,其激活效率明显下降。
单链DNA(ssDNA)的激活效率也较低,这可能与实验中使用的LwaCas13特性有关,若换用LbuCas13可能会有所改善。
由单链RNA及其互补RNA(cRNA)组成的双链RNA可激活系统,Cas13系统能直接将其解离且无需PAM序列,但效率低于单链RNA。
ssRNA和cDNA混合时,虽然也能激活系统,但效率更低。
因此最终选择ssRNA和cRNA组合作为系统的基础。
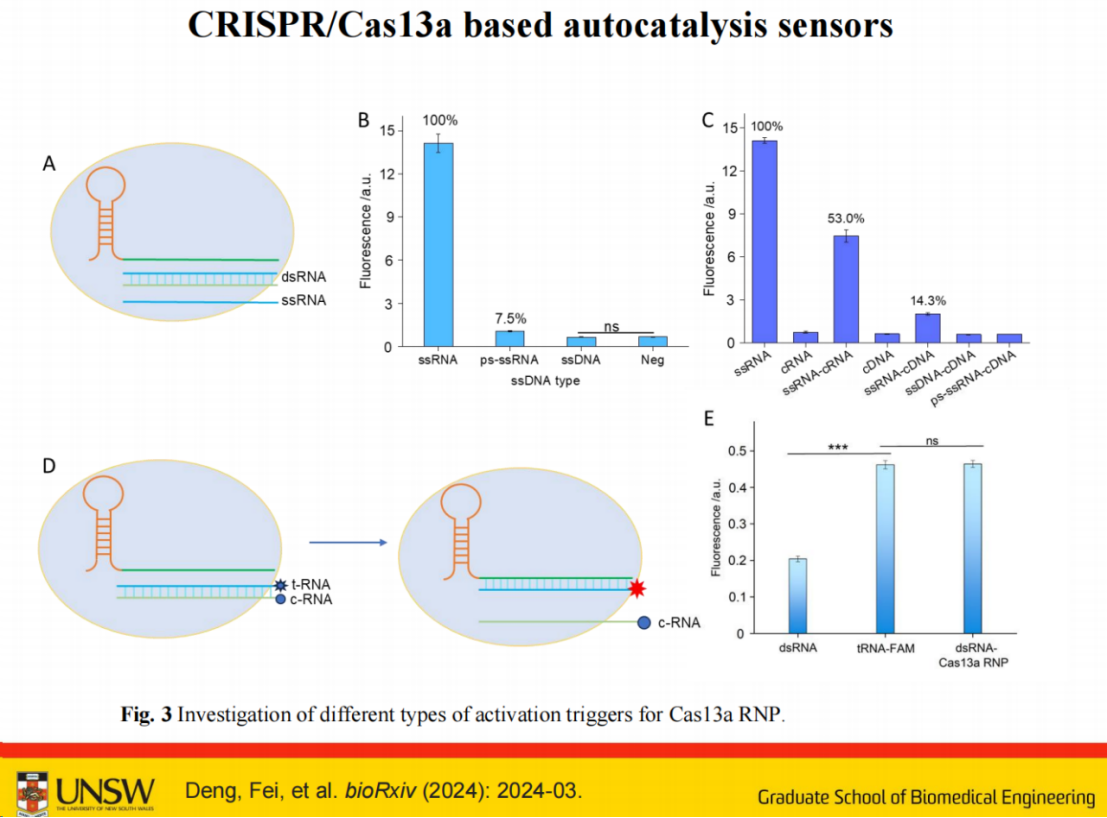
通过FRET实验进一步证实,双链RNA与Cas13 gRNA结合后可激活检测系统,其荧光信号能恢复到单链状态,表明Cas13a可将靶RNA从cRNA上分离。
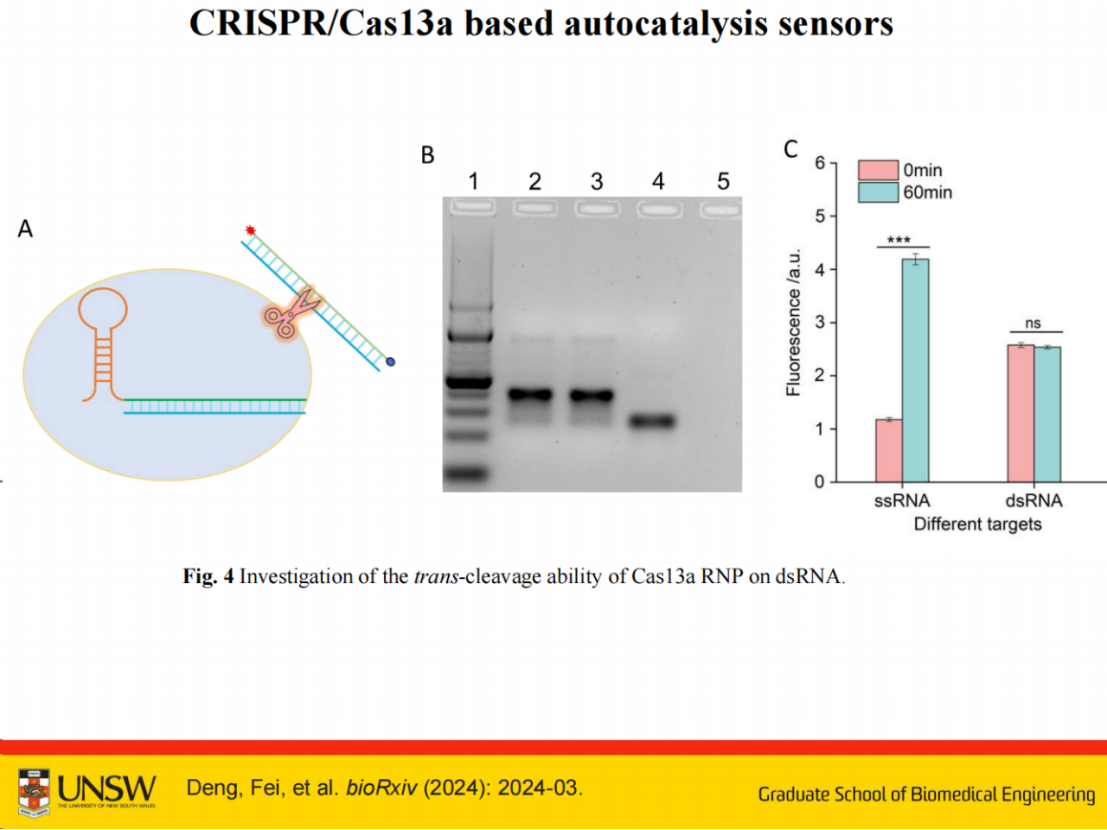
后续实验证明,Cas13a RNP激活后不会切割双链RNA,如实验4和5所示。实验4未检测到剪切,证实双链RNA未被切割。荧光监测显示双链RNA切割时荧光强度未发生变化。
该系统可实现指数级荧光信号震荡,而传统仅使用Cas酶的系统仅能实现线性震荡。
在检测范围方面,该系统尚难以精确区分100amol和200amol等相近浓度,但对于"有/无"或较大差异的样本具有良好区分能力。
(2) 如何进一步提高系统的通用性?
为提高系统实用性,我们将其改进为双RNP设计:第一个RNP用于识别靶标RNA并剪切环状介体,线性化的介体不会激活Cas13a RNP1,而是激活专门针对双链线性介体设计的Cas13a RNP2,从而在第二步反应中形成自催化。
该设计的优势在于其通用性——实际应用中只需将环状介体和Cas13a RNP整合至系统核心,根据具体靶标进行设计即可实现信号放大。该系统对miRNA-21的特异性检测效果良好,并展现出较宽的检测范围。
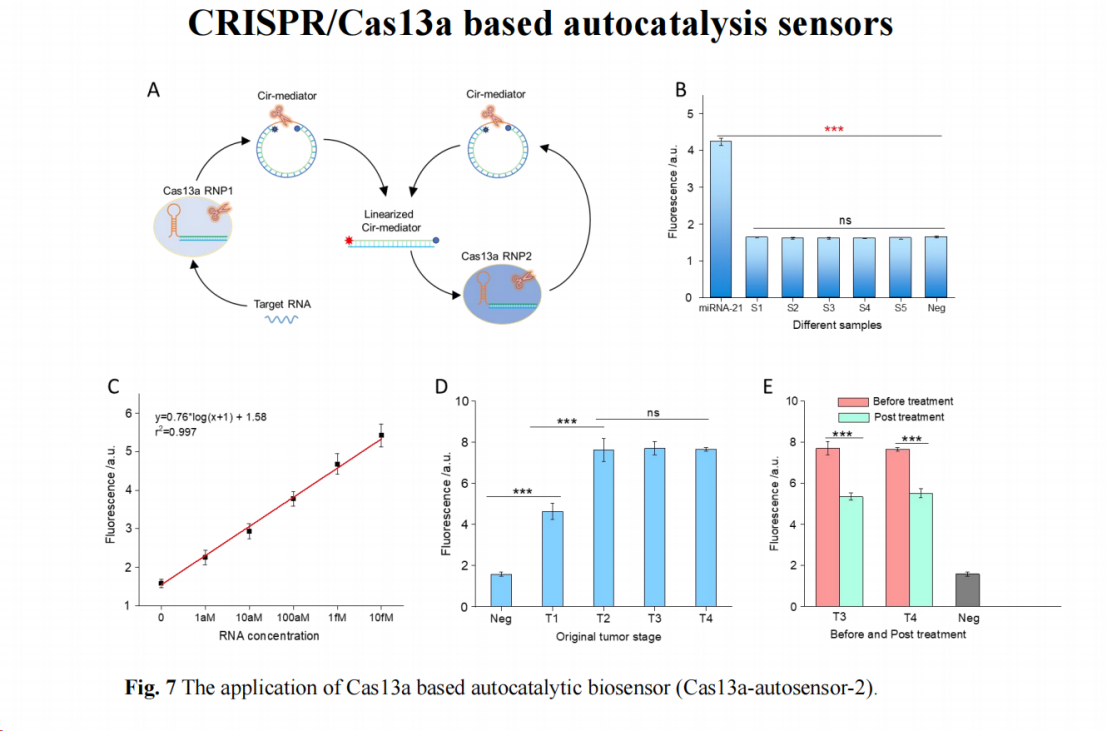
在临床样本测试中,我们库获取了不同分期的结直肠癌(CRC)样本。测试结果显示,该系统能有效区分不同分期的样本,其区分度与RT-PCR结果相近(具体数据未展示)。此外,该系统还能区分治疗前和治疗后的样本差异,表明其在定性检测和大差异样本区分方面具有良好性能,但在精确定量方面仍有提升空间。
这是我们设计的另一种串联系统,该系统与自动催化系统不同。
通过检测DNA-RNA杂交产物中的发夹锁结构(Hairpin-locker)启动。当Cas12剪切目标DNA后,释放的RNA会进一步激活Cas13 RNP,从而形成一个简单的Cas12-Cas13串联系统,实现信号放大功能。
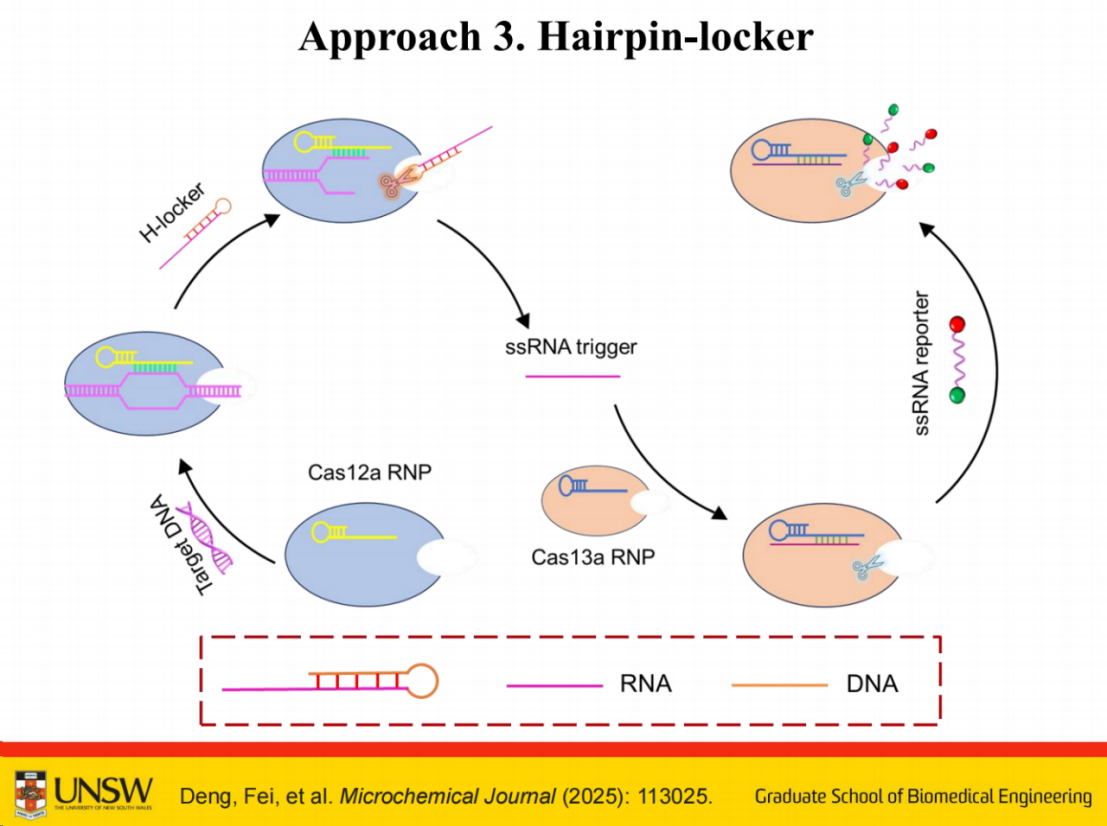
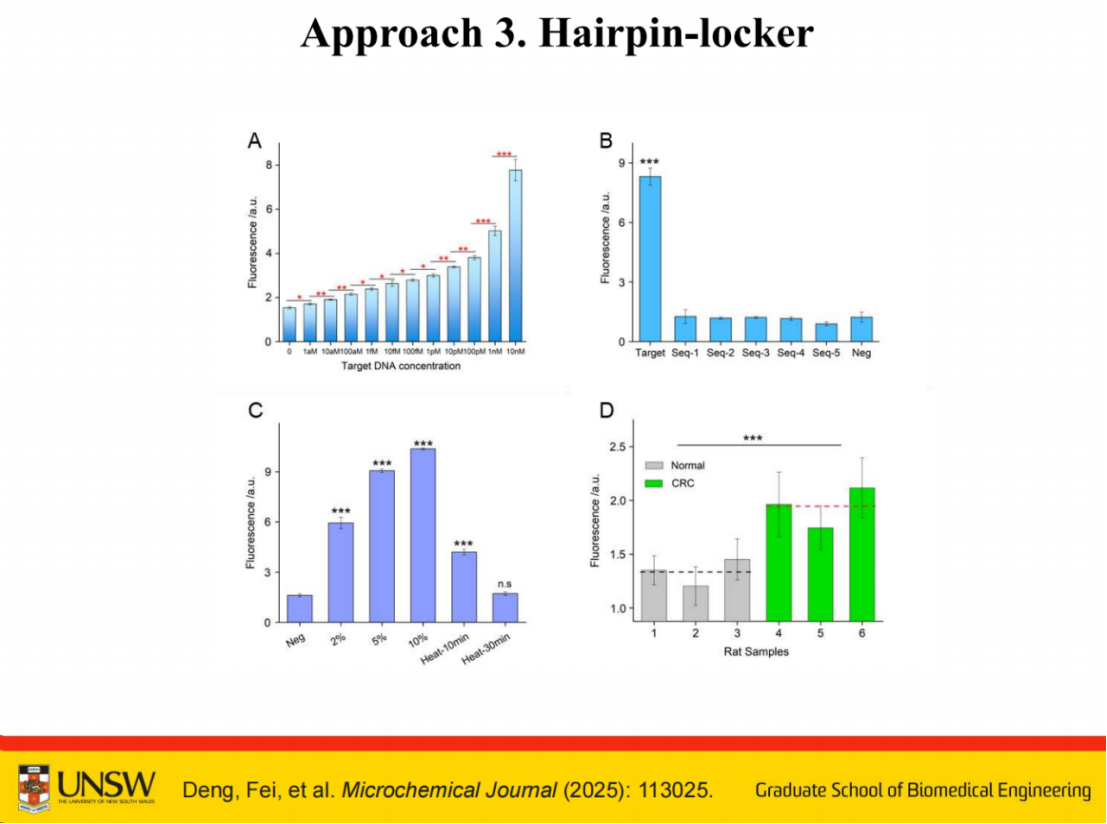
我们开发这个串联系统的原因在于,前期研究发现自动催化系统在区分特定浓度范围时的性能表现不够理想。
数据显示,相比之下,该串联系统在特异性方面展现出优于自动催化系统的表现。但仍有提升空间。
然而,该系统存在一个局限性:在检测唾液样本时,由于口腔直接采集的唾液中酶含量较高,会破坏系统中的中间介体(mediator)。
因此,针对唾液等特殊样本,必须进行预处理,包括添加蛋白酶抑制剂并进行加热处理。经过这些处理后,该系统可用于结直肠癌样本与正常样本的区分检测。
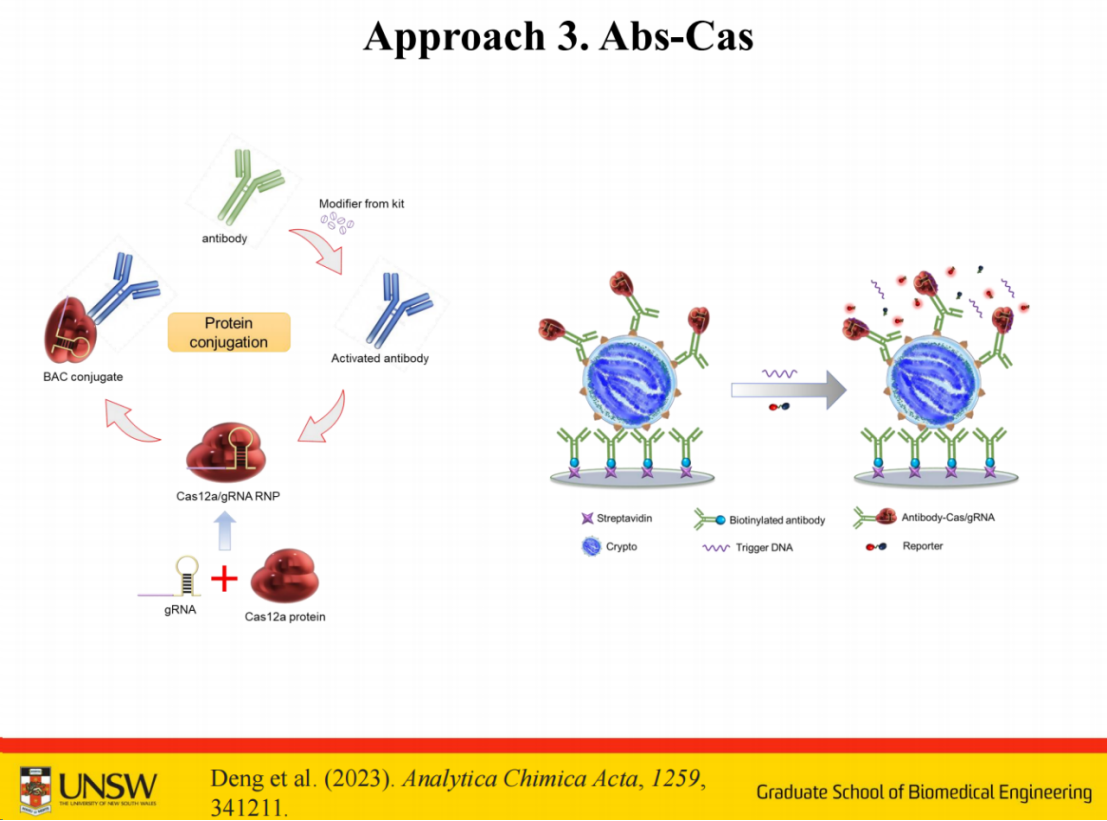
我们还尝试拓展了CRISPR在非核酸检测的应用。由于CRISPR系统天然适用于核酸检测,在进行非核酸检测时需要引入转换机制。可以用适配体或抗体等进行中间转换。

我们尝试了两种方法:
第一种是将抗体固定后,通过抗体识别靶标,再与适配体形成三明治结构。洗脱游离适配体后,靶标激活Cas酶进行信号放大。
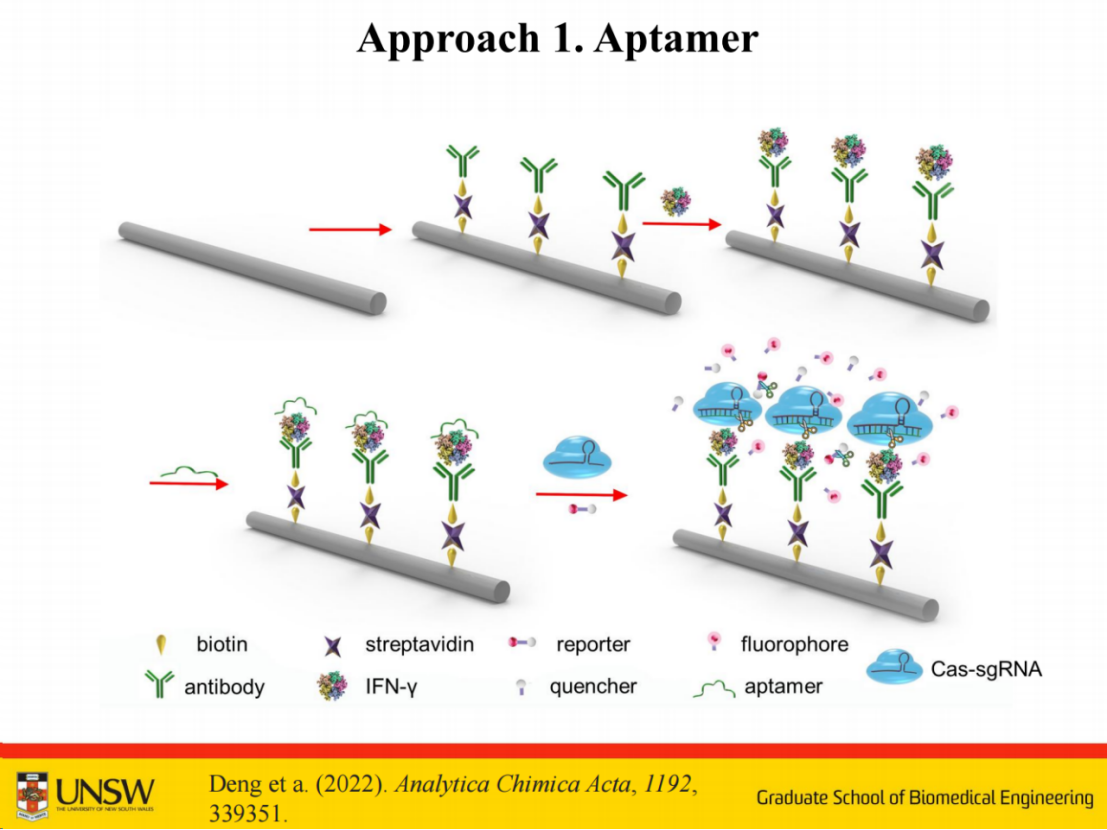
第二种方法是在抗体上直接连接更多短链,具体是在检测抗体后端使用链霉亲和素,采用常规键合方式可连接三个链霉亲和素分子,从而使短链数量增至10-12条,显著提升了信号放大效果。
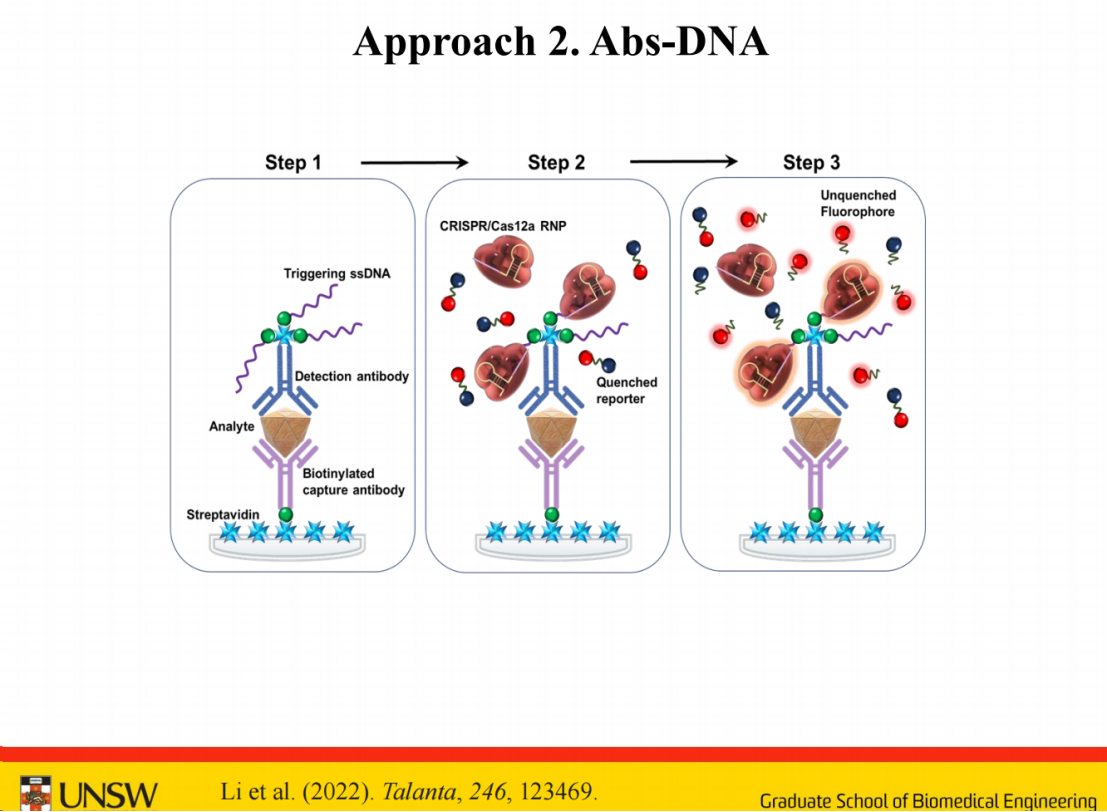
在结构设计方面,虽然示意图中展示的是单链结构,但实际应用中单链或双链均可采用。考虑到单链可能形成特殊二级结构影响启动效率,采用双链结构可能更为稳定。若使用双链结构,需要添加PAM序列,这将可能进一步提升系统性能。
以下图片展示的技术是在以上系统基础上进行的拓展应用。
具体而言,在无需改变原有系统架构的情况下,仅需使用检测抗体和捕获抗体完成靶标识别后,即可利用可标记抗体识别第二个靶标的特定特征。
这种设计既可以通过识别抗体的Fc区段实现信号放大,也可以识别抗体上标记的辣根过氧化物酶(HRP)。这种模式在酶联免疫吸附试验(ELISA)试剂盒中已有成熟应用。虽然该方法具有更好的通用性,但系统复杂度相对增加。
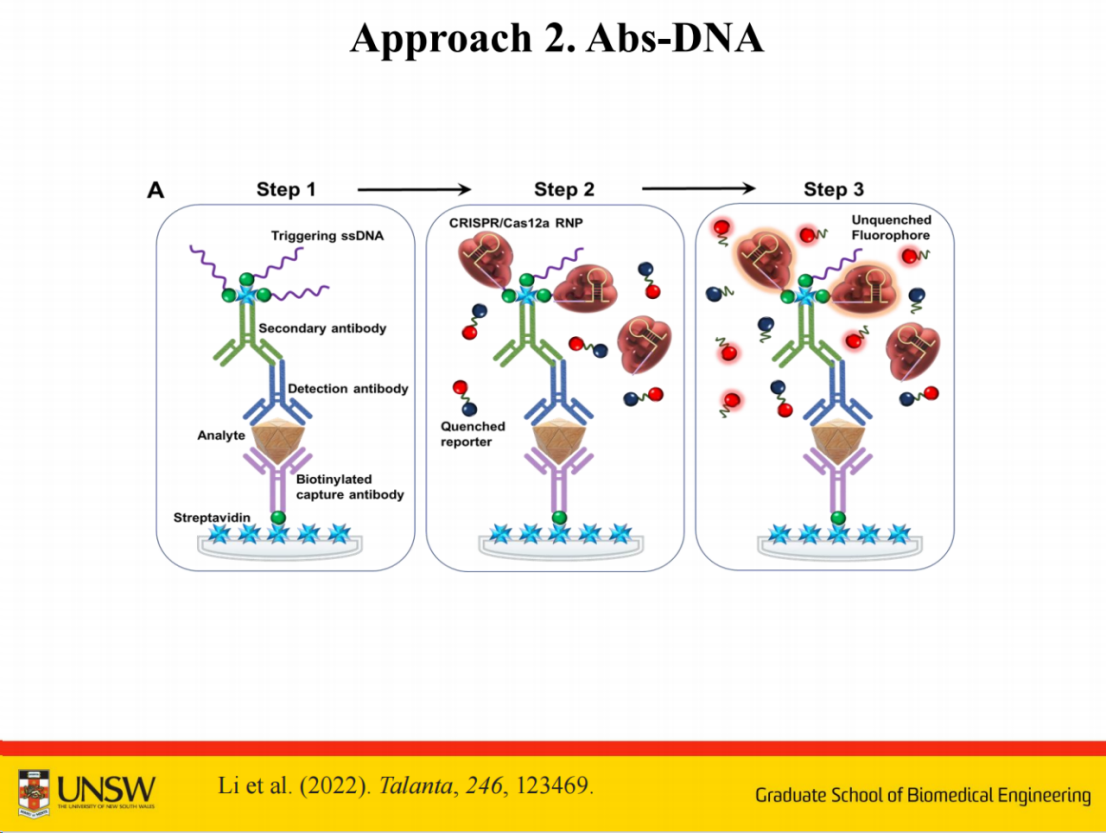
在具体应用方面,该技术已成功用于水体中隐孢子虫的检测。
隐孢子虫是一种水生寄生虫,其检测具有重要的公共卫生意义。例如澳大利亚政府就将其列为重点检测对象,因为仅需10个寄生虫即可引发人体腹泻症状。
本研究是与澳大利亚 BioPoint Pty Ltd 公司合作开展。在检测过程中,系统通过形成三明治结构实现对隐孢子虫的识别。隐孢子虫的尺寸约为4微米,体积较大,可采用单一抗体实现检测。
该检测采用与常规ELISA类似的简单三步流程:
(A) 步骤一:加入样本以捕获目标隐孢子虫细胞;
(B) 步骤二:加入预制备的抗隐孢子虫抗体-ssDNA偶联物,形成抗体-细胞夹心结构;
(C) 步骤三:加入预混CRISPR/Cas12a反应体系,识别抗体-ssDNA偶联物上的触发式单链DNA,激活Cas12a核糖核蛋白复合体(RNP);
(D) 最终:激活的CRISPR/Cas12a RNP通过反式切割猝灭荧光报告分子,产生级联放大信号用于检测。
即便单个抗体仅能识别部分表位,剩余部分仍可通过相同抗体实现识别,最终成功实现了单个隐孢子虫的检测。
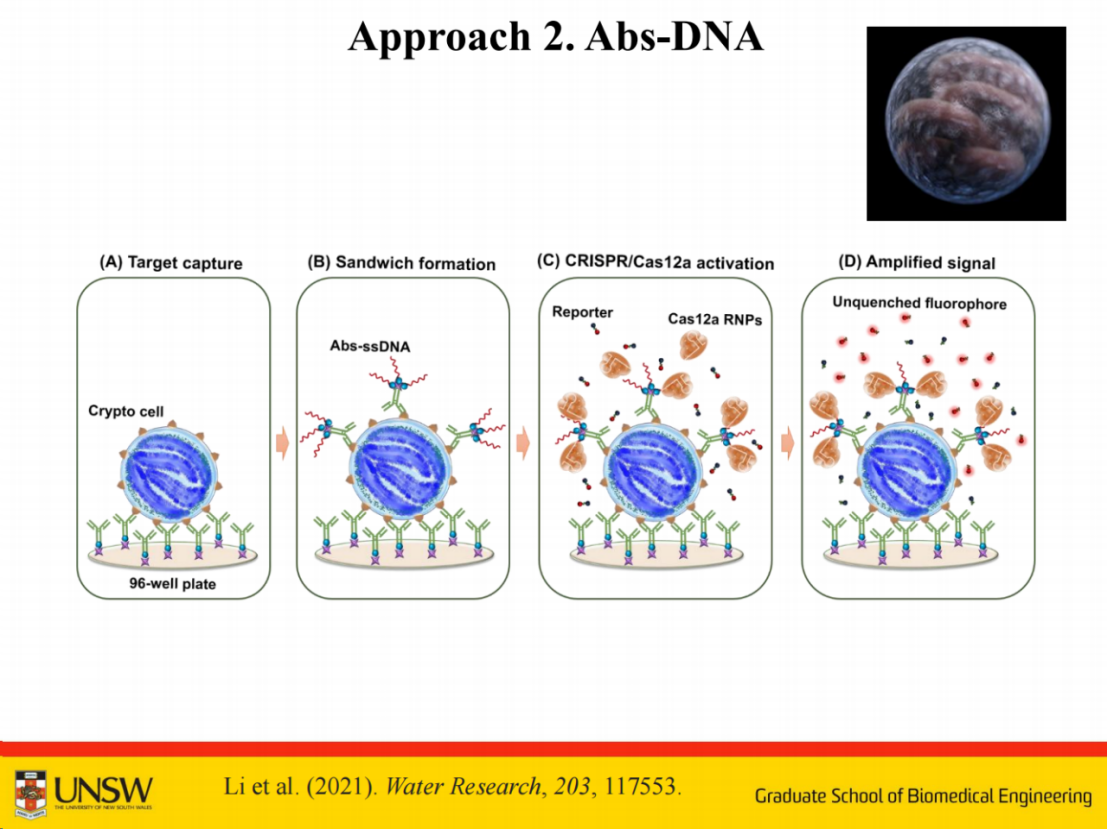
该检测系统具有良好的通用性,可拓展应用于其他寄生虫如贾第虫或环孢子虫的检测。
此外,研究团队还探索了另一种替代方案,即将抗体直接与Cas-RNP结合,该过程通过化学方法实现。若采用其他酶学方法,可能会获得更好的检测效果。





发表评论 取消回复