本期分享华南师范大学周小明研究员报告:《CRISPR分子诊断技术研究的一点探索》。



2025年8月2日,由中国医药生物技术协会生物诊断技术分会主办,第二期生物诊断前沿技术专题会在江苏省无锡市惠山生命科技园召开。专题会聚焦CRISPR免扩增与非核酸检测技术。
生物诊断公众号将对各专家汇报内容进行汇编整理,供关注CRISPR诊断技术的业内同仁学习参考。
本期分享华南师范大学周小明研究员报告:《CRISPR分子诊断技术研究的一点探索》。

以下为周小明教授的部分报告内容:
注:报告由生物诊断平台整理汇编,内容仅供学习参考。

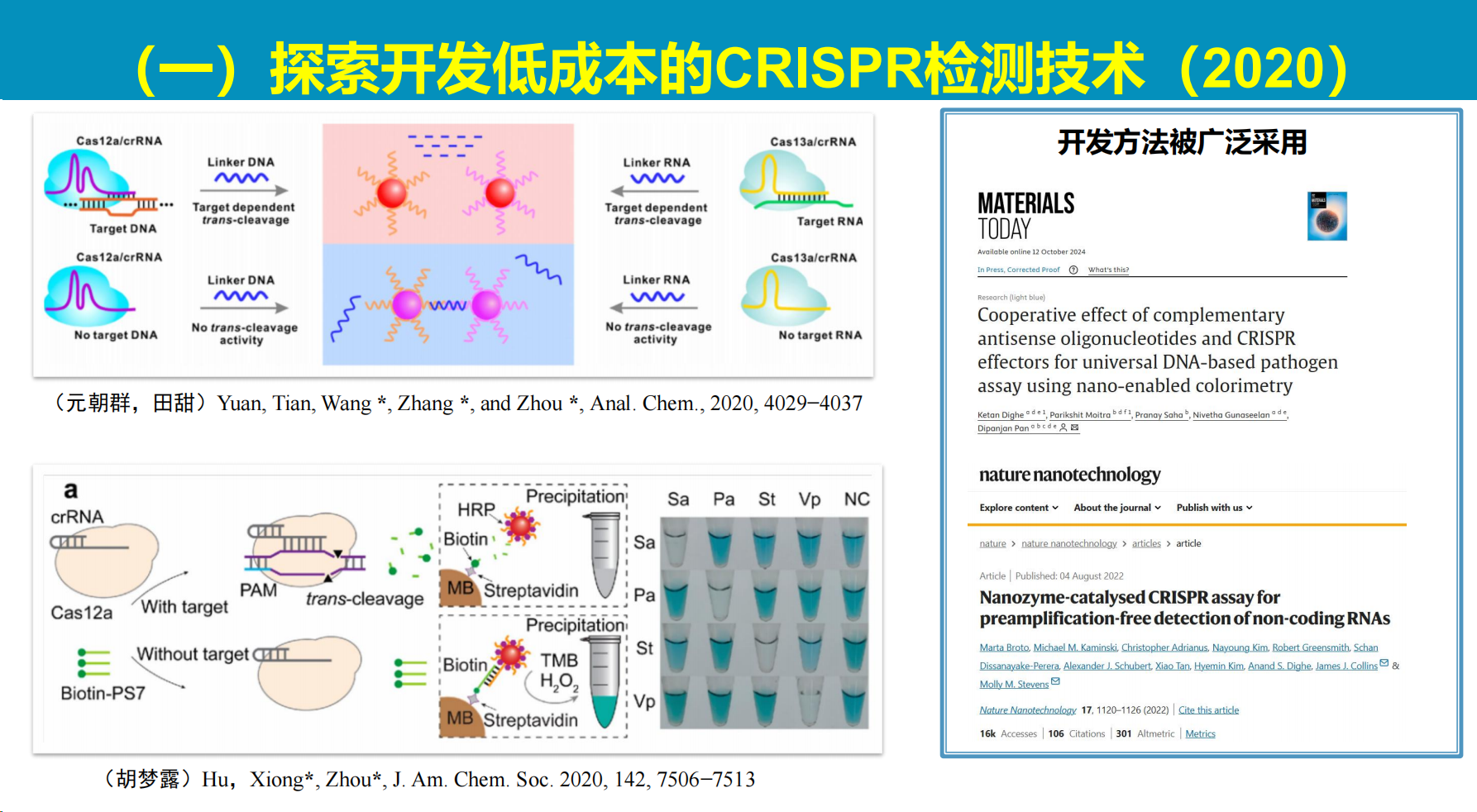
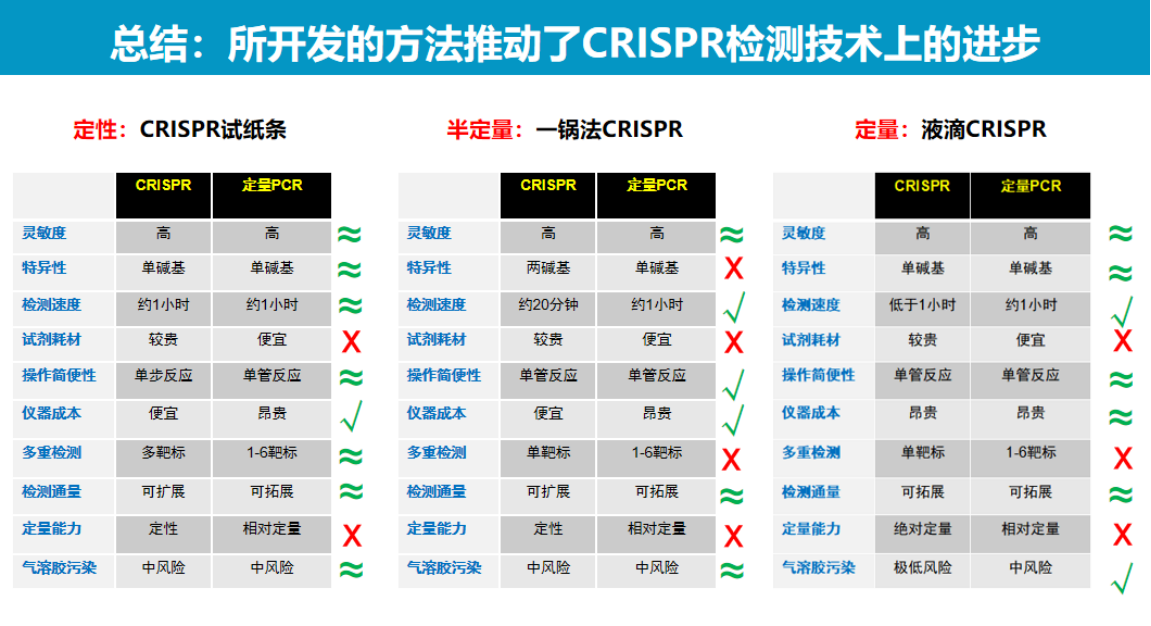
我们的工作主要围绕三个技术平台展开:定性目的的低成本CRISPR检测技术、半定量荧光一锅法检测技术,以及定量数字化CRISPR检测技术。

CRISPR检测技术在医学诊断领域具有广泛的应用前景。
在急性传染病检测方面,该技术可用于病原体核酸的快速检测;
在重大慢性病诊断方面,则适用于基因异常表达、基因融合及基因突变等检测。

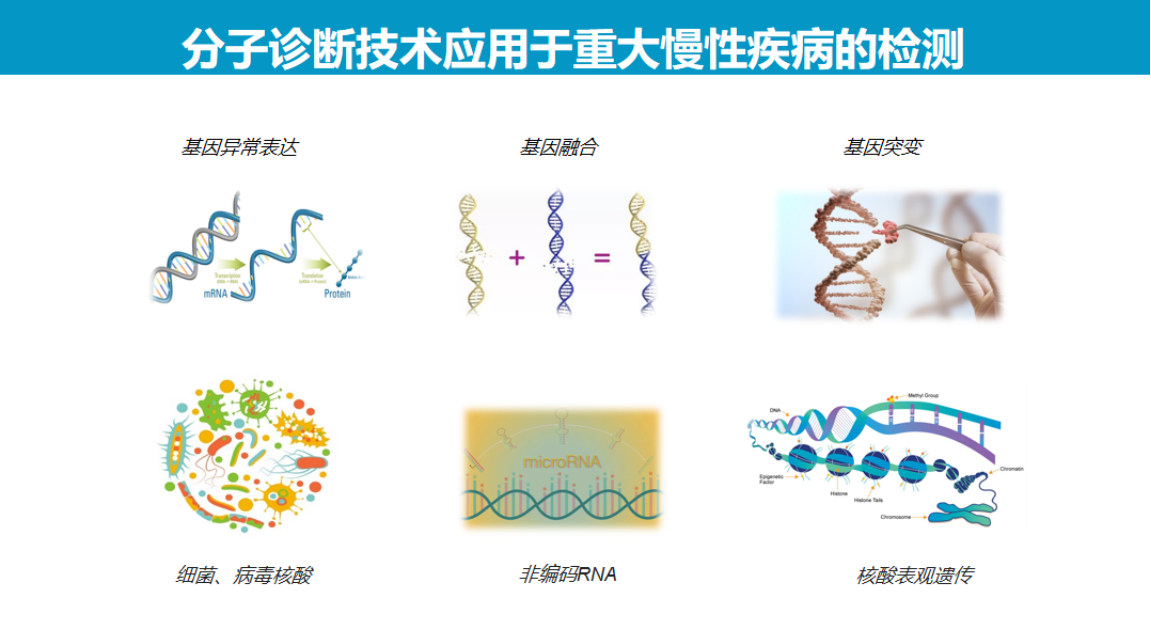
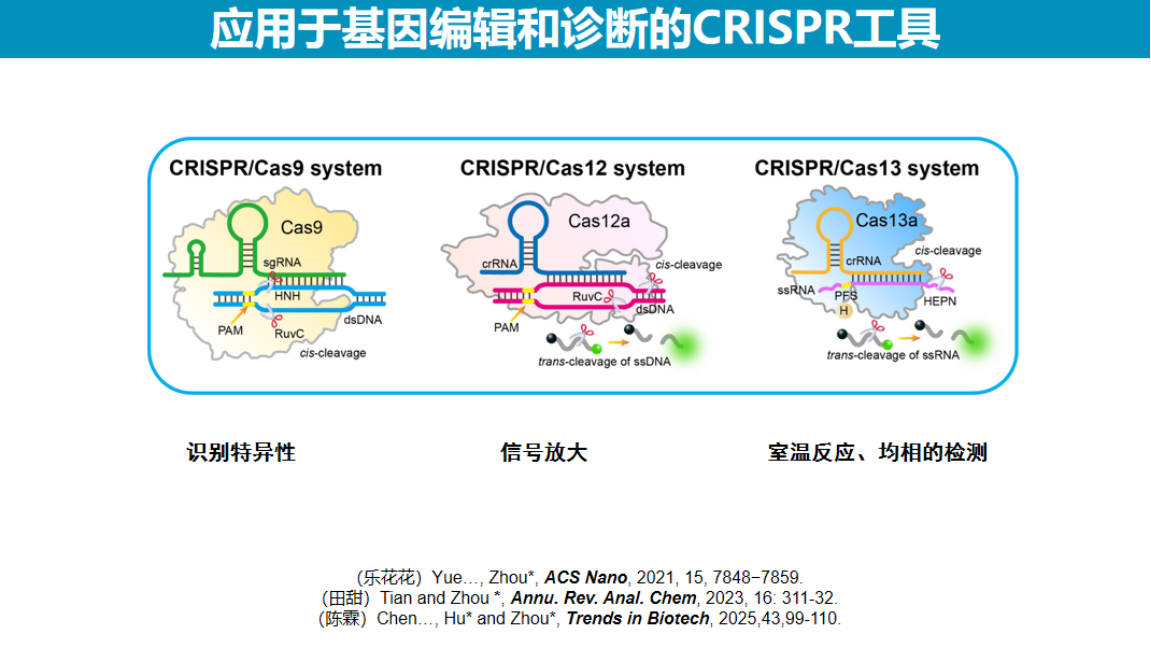
目前CRISPR诊断技术主要采用三类Cas系统:Cas9、Cas12和Cas13。
根据以往认识,Cas9和Cas12识别DNA,Cas13识别RNA。近年研究发现这些系统在底物识别方面展现出更广泛的特性:以上Cas系统均具备识别DNA和RNA的能力,同时兼具顺式切割和反式切割活性。
CRISPR诊断技术的发展历程可追溯至早期Cas9系统在寨卡病毒分型中的应用研究。
然而该技术在当时存在通用性不足的局限,其分型原理依赖于病毒突变产生的特定PAM位点。

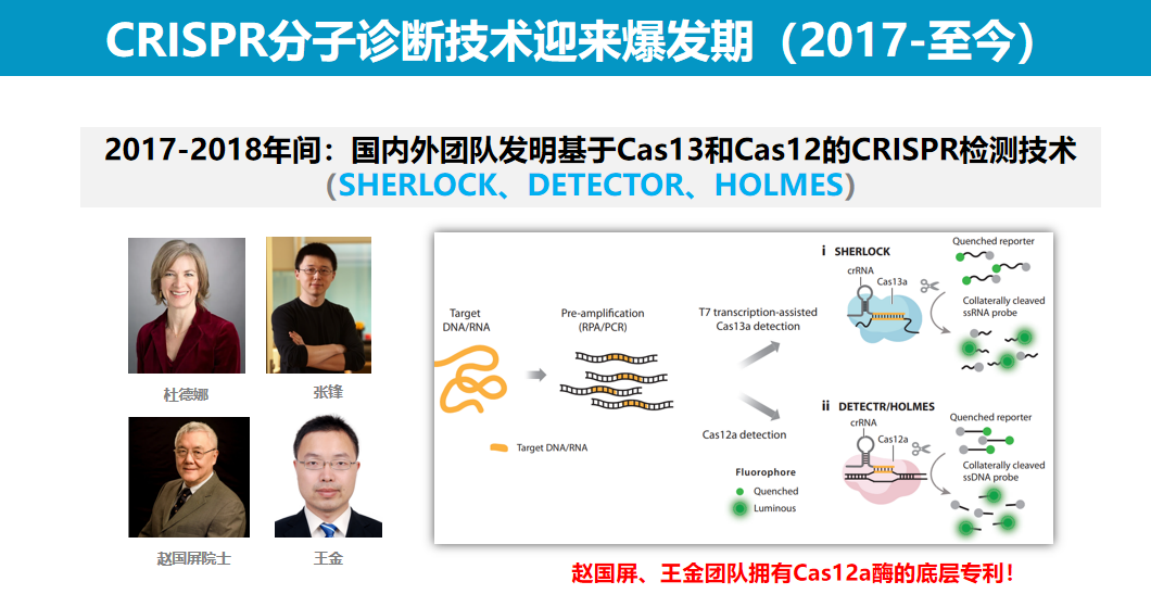
真正的技术突破出现在2017年底至2018年期间:张锋团队率先利用Cas13开发了SHERLOCK系统;
随后,王金教授团队与加州大学杜德娜团队先后发现了Cas12的反式切割活性,由此诞生了包括DETECTR和HOLMES在内的多个具有自主知识产权的原创技术体系。
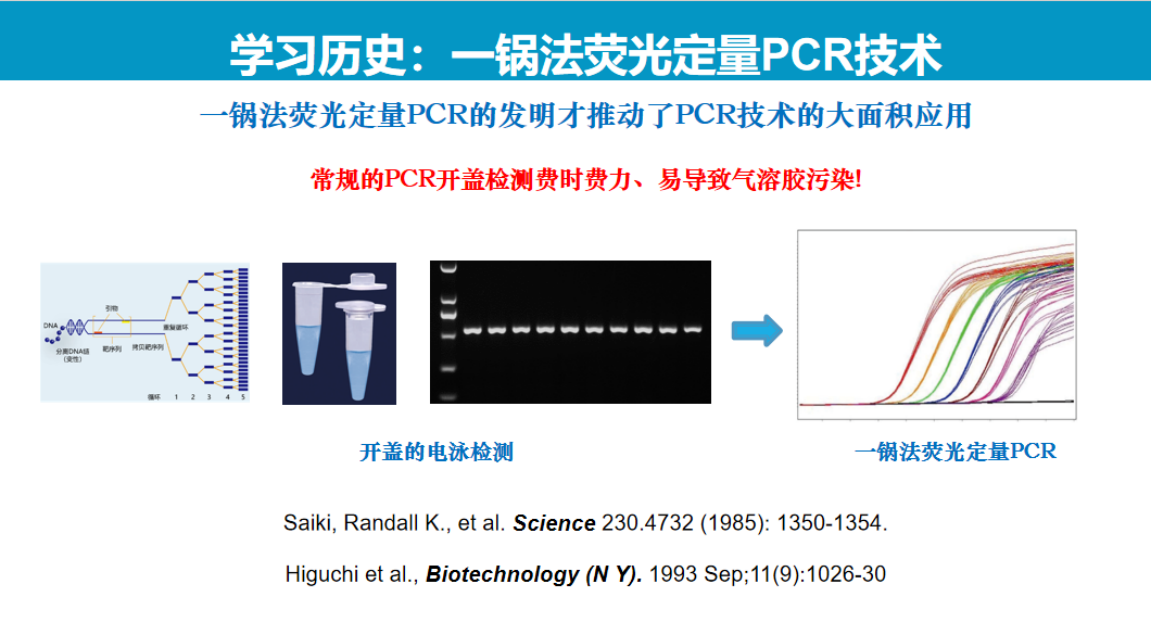
从技术发展历程来看,核酸检测技术的演进可参照PCR技术的发展轨迹。
PCR技术自1983年发明以来,经历了漫长的发展过程:1993年罗氏开发的一管法荧光定量PCR技术实现了从电泳检测到实时检测的突破;数字PCR技术虽然在20世纪90年代即出现原型,但直到2013年才由伯乐公司实现产品化。
在此期间,罗氏、赛沛和梅里埃等企业通过自动化与多重检测技术的创新,推动了PCR技术的广泛应用。
相较而言,CRISPR诊断技术虽发展时间较短,但已展现出快速发展的态势。

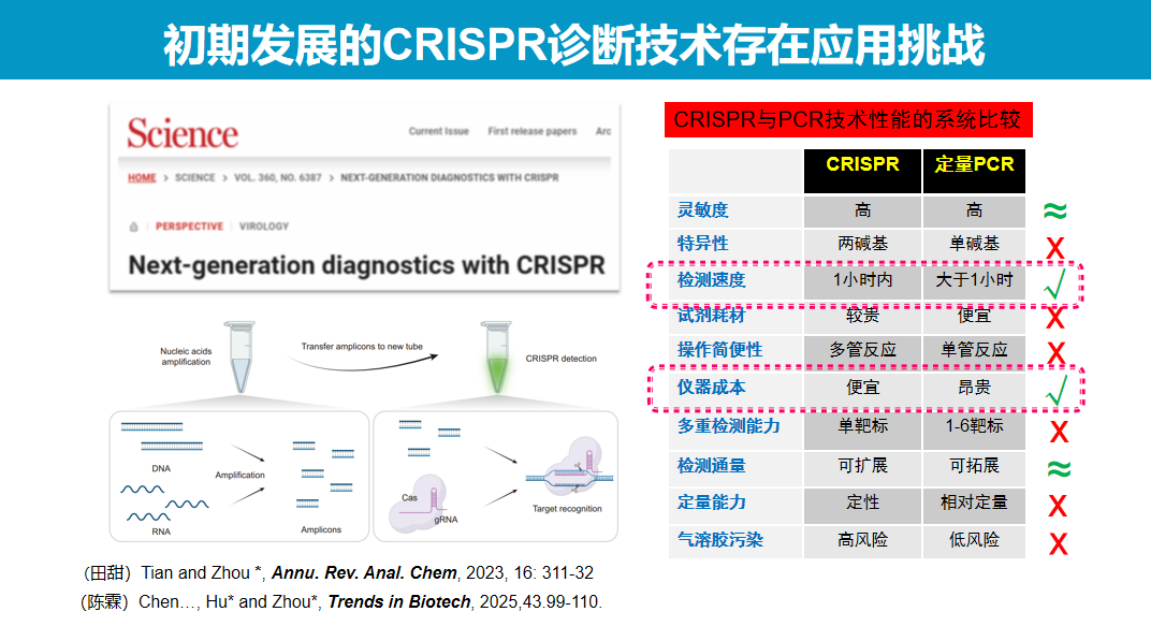
2018年CRISPR技术问世之初,尽管在多项性能指标上尚未超越传统定量PCR技术,但其凭借显著的技术优势仍获得学界高度关注。
《Science》杂志曾发表观点文章,明确指出该技术有望成为下一代诊断技术的代表。通过系统对比CRISPR与定量PCR技术可发现,早期CRISPR技术在检测方法标准化、操作流程及综合性能等方面尚未显现明显优势。
根据对关键指标的评估,该技术在部分方向上最初仍落后于PCR技术。
然而,CRISPR技术具有两个突出的核心优势:
首先是检测速度优势。CRISPR技术结合等温扩增可在约10分钟内完成检测,而传统快速PCR通常需要1小时。
其次是设备成本与便携化优势。从技术发展潜力来看,CRISPR系统未来完全可能开发出高度简化的便携式检测设备。
这两个关键优势为CRISPR技术的后续发展奠定了重要基础。
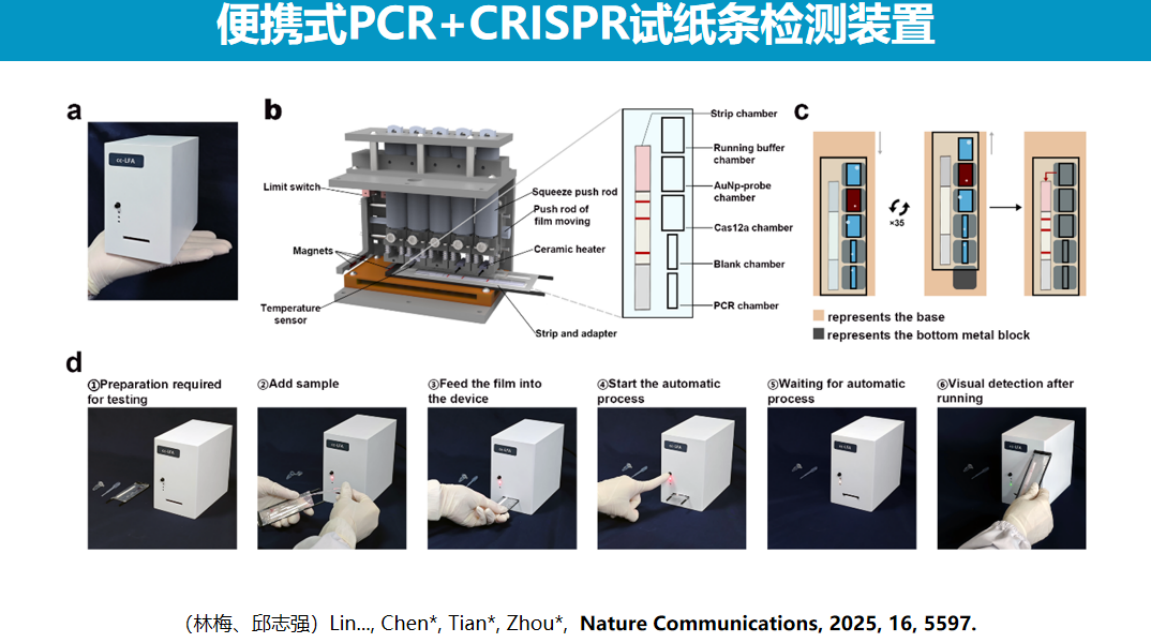
本实验室最早于2016年开发了基于金纳米颗粒颜色变化的低成本CRISPR检测技术,该技术利用金纳米颗粒的分散与聚集产生的颜色变化作为信号输出。
然而该方法存在操作步骤繁琐的局限性,需进行多次液体转移和试剂添加,无法实现一锅法检测。
基于此,我们转向开发更为简便的试纸检测技术,利用硝酸纤维素膜的自动化特性简化操作流程。
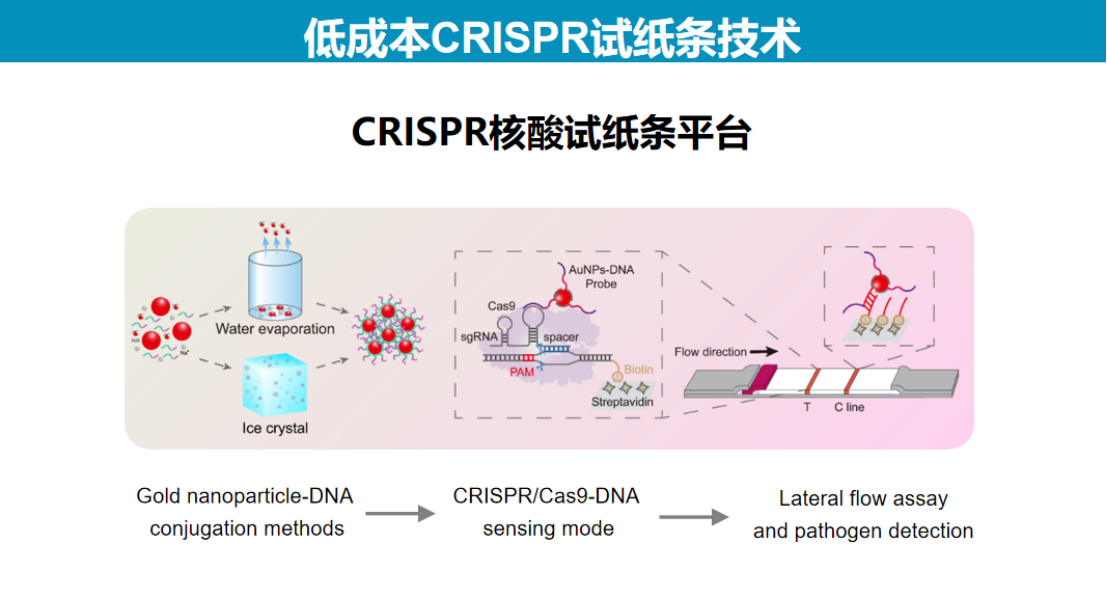
1、胶体金-核酸探针标记技术的优化
在试纸检测技术开发过程中,金纳米颗粒探针与核酸的标记是关键环节。
传统的盐调控标记方法存在明显局限:由于金颗粒与核酸均带负电荷导致相互排斥,需通过缓慢加盐屏蔽电荷实现标记,整个过程耗时长达2-3天。这严重制约了技术的商业化应用前景。
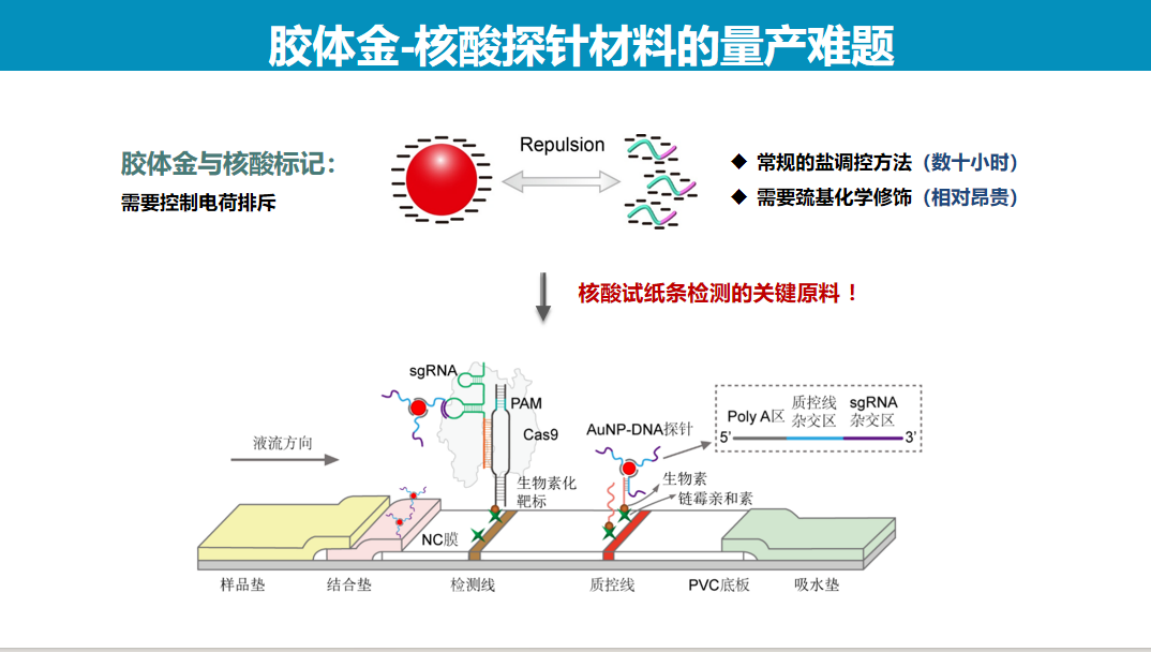
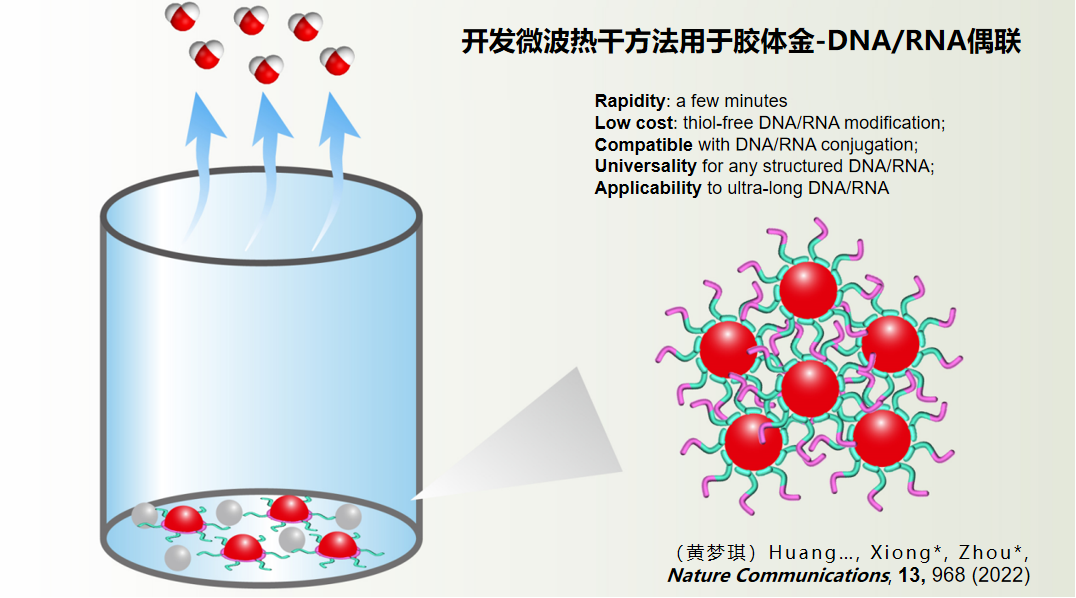
针对这一技术瓶颈,我们创新性地开发了两种物理标记方法。
第一种冷冻压缩法通过结冰过程将金颗粒与核酸压缩至微小冰屑体积内强制反应,标记时间缩短至1小时(超低温冰箱)或10分钟(液氮)。但该方法受限于核酸二级结构对标记效率的影响。

第二种微波加热干燥法通过同时施加加热与干燥两个物理条件实现高效标记。
该方法源于实验中的偶然发现:微波加热可在几分钟内完成标记,且能有效破坏核酸二级结构。
这一创新技术不仅显著提高了标记效率,还解决了序列结构带来的技术难题,目前已成为该领域广泛认可的标准方法。中国化学杂志近期发表的综述文章中提及了本团队在核酸标记技术领域做出的贡献。

2、定性目的的低成本CRISPR检测试纸条开发
在试纸条开发过程中,研究团队最初尝试使用Cas9系统进行检测。
这一选择主要基于简化操作流程的考虑。传统核酸试纸条技术依赖于探针杂交,需要温控模块且存在杂交效率低的问题,因为双链DNA在加热解链后容易复性。采用Cas9识别靶标的方式可以避免温度调控问题。
然而,Cas9系统存在特异性不足的缺陷,即对不完全匹配的序列也可能产生结合,这限制了其在精准检测中的应用。
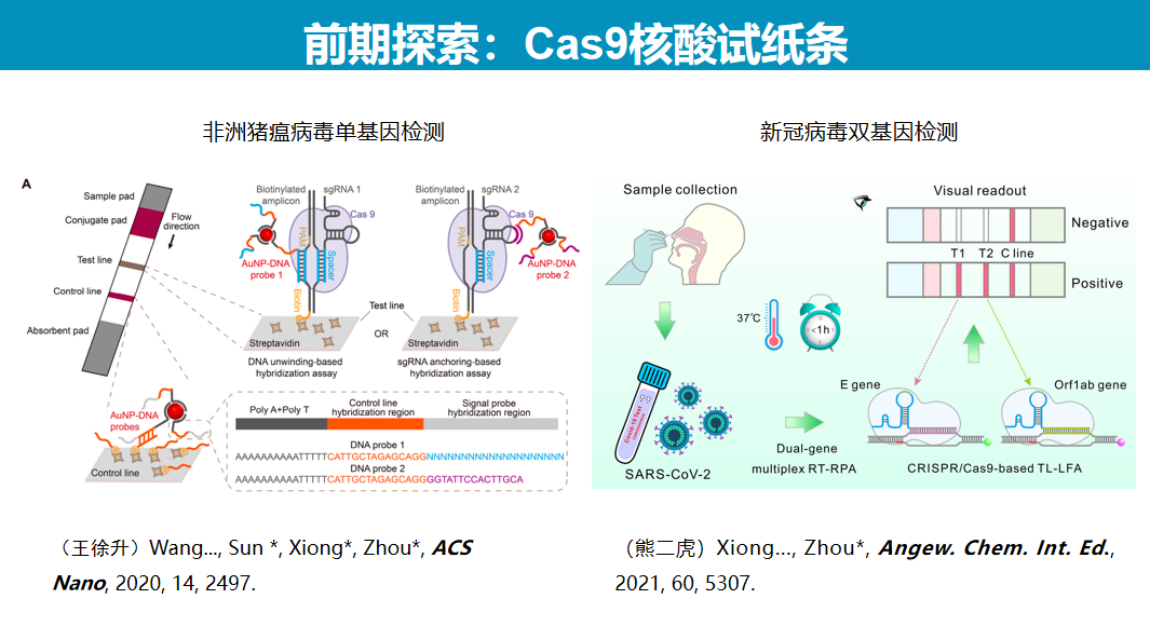
为解决这一问题,研究团队转向使用Cas12a系统,开发了基于切割模式的新型检测方法。
Cas12a切割双链DNA会产生具有粘性末端的产物,且PAM远端的切割产物会与Cas12蛋白快速分离。研究团队设计了一条单链DNA探针,通过链入侵杂交的方式特异性识别这些粘性末端产物。
这一技术具有双重特异性保障:首先,Cas12a的切割过程本身具有一定特异性;其次,即使发生错误切割或PAM远端序列存在不匹配,后续的链入侵杂交过程也能通过单碱基特异性识别进一步确保检测准确性。因此,该方法比单纯的顺式切割具有更高的特异性。
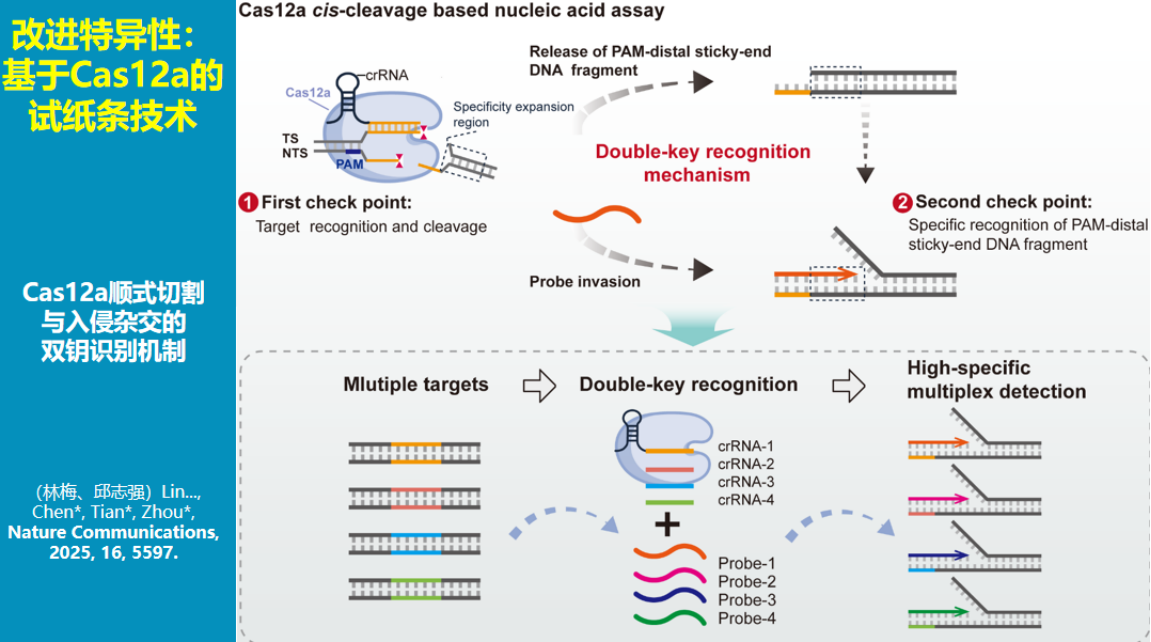
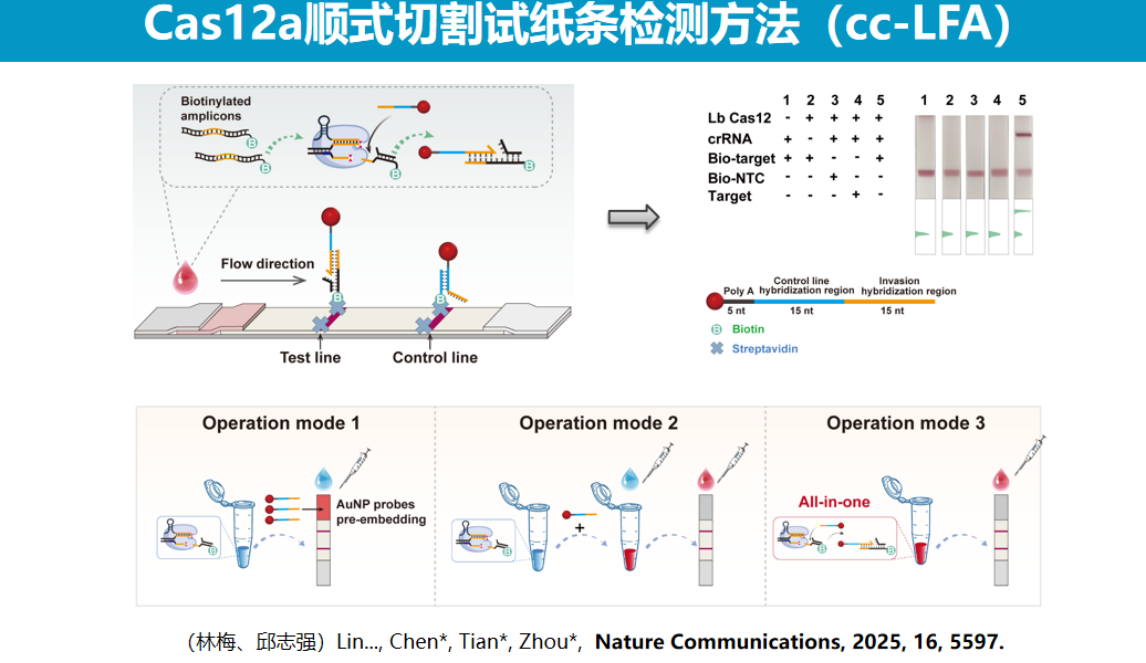
该技术的一个显著优势是易于实现多重检测。
由于不同靶标会产生不同的切割产物,通过设计相应的链入侵探针即可实现多重识别。
基于顺式切割机制实现多重检测一直是CRISPR技术领域的难题,而该方法为解决这一问题提供了新思路。理论上,多重检测的通量可根据探针设计灵活调整,在芯片模式下甚至可实现上百重的检测。
在应用方面,该技术已成功用于呼吸道病原体(如SARS病毒、流感A/B病毒)的多重检测。
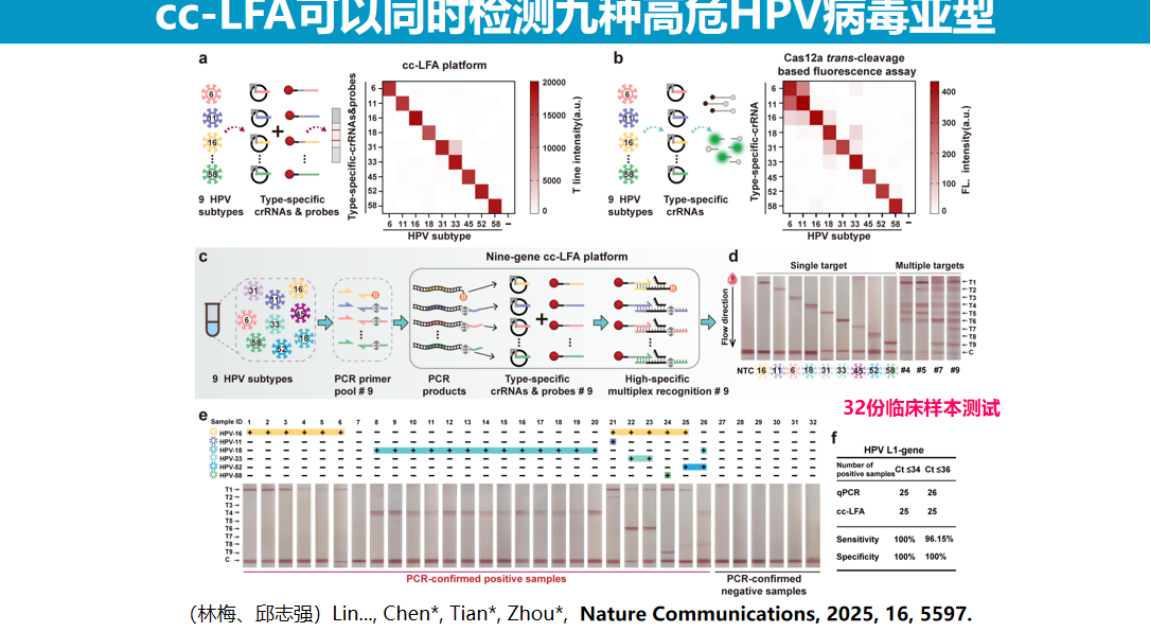
同时,团队在试纸条上成功实现了HPV九种病毒亚型的检测,实验数据表明该方法的特异性优于单纯依赖反式切割的检测方案,在相似序列情况下仍能保持高特异性,九种HPV亚型检测结果间几乎不存在交叉干扰。

研究团队进一步将PCR扩增与试纸条检测模块整合,采用膜包被试剂的形式,初步验证了这一整合方案的可行性。
罗氏公司近期公布的专利技术也采用了PCR与CRISPR结合的一体化检测模式。

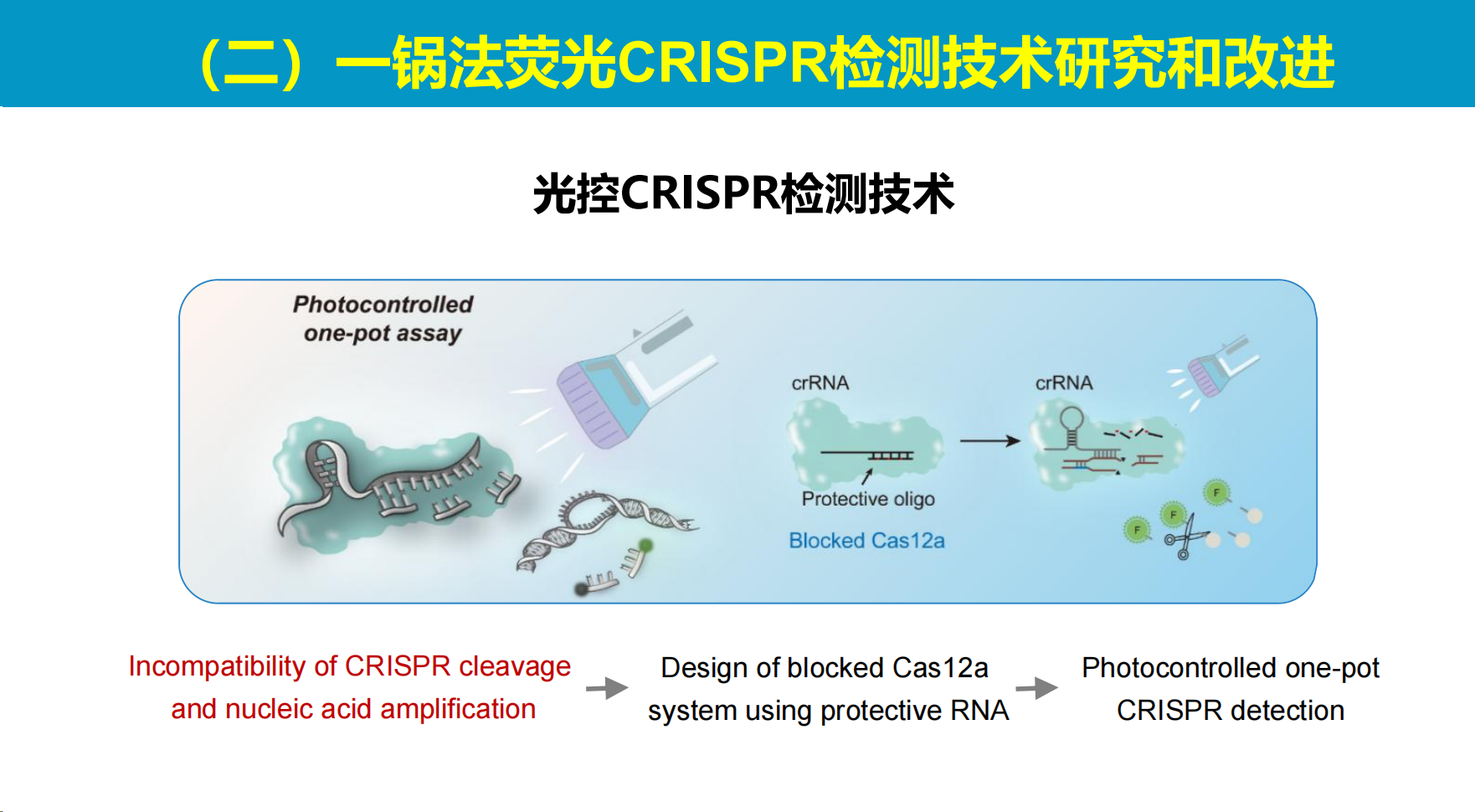
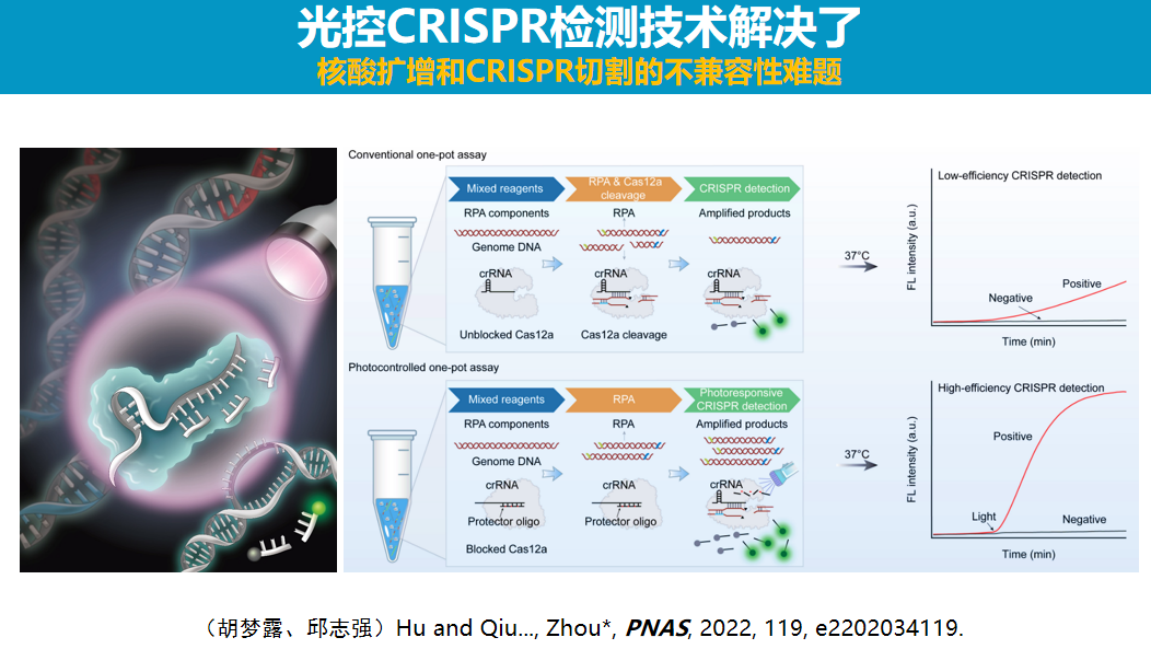
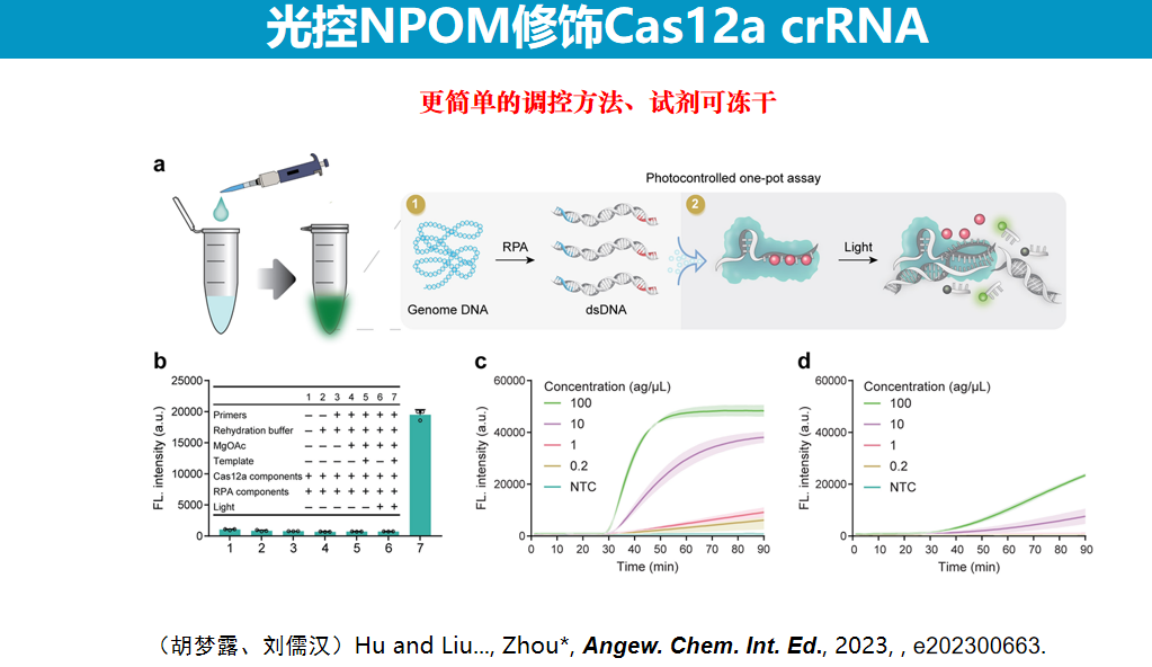
本部分介绍研究团队开发的基于光调控技术的"一锅法"荧光检测方法,该方法旨在实现高灵敏度、简便且无气溶胶污染的核酸检测。
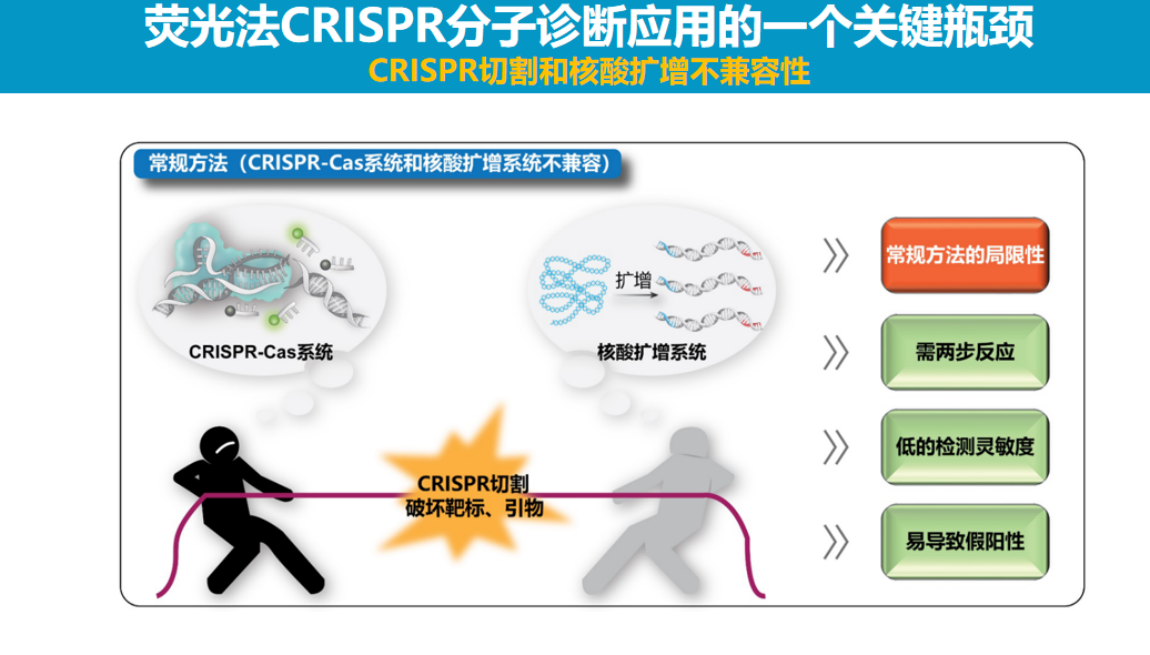
实现"一锅法检测"面临的主要挑战是PCR扩增与CRISPR检测试剂的兼容性问题。
回顾PCR技术的发展历程,早期PCR同样采用两管法操作,直到1993年罗氏公司开发出将扩增与检测整合在单一试管内的技术后,PCR才真正得到广泛应用。这种一体化设计不仅减少了气溶胶污染风险,还显著简化了操作流程。
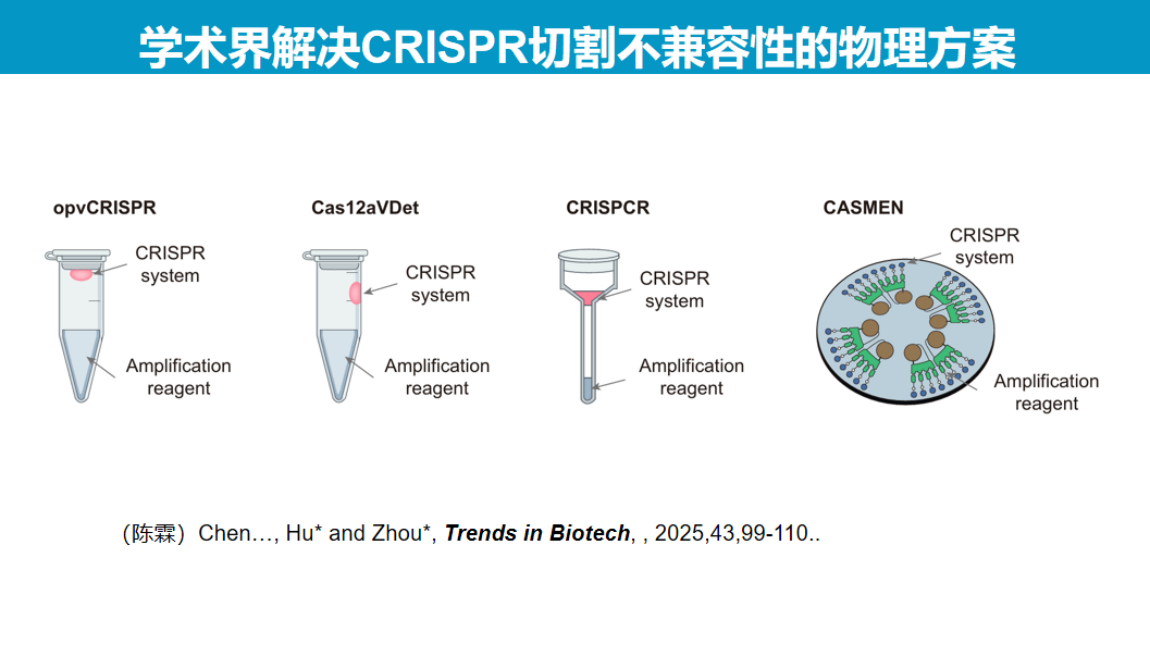
研究团队采用光调控策略解决这一问题,其核心思路是通过可逆抑制Cas酶活性来实现反应控制。
1、初代光控CRISPR技术
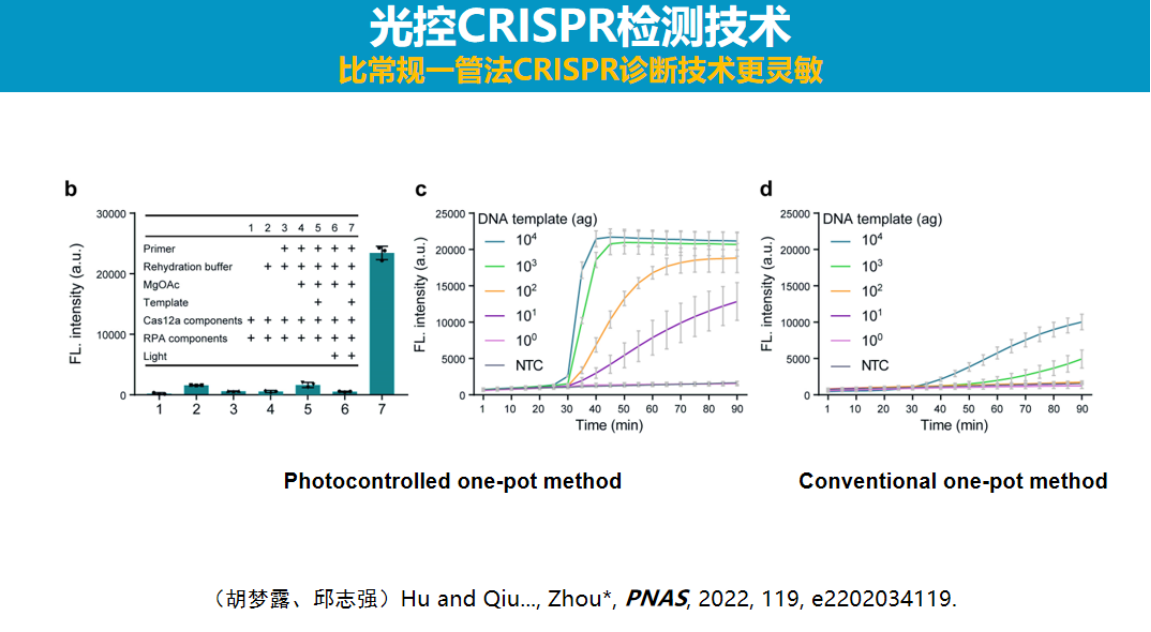
团队研发的初代光控技术采用设计互补核酸链封闭引导RNA的方法,在光照射下封闭链断裂后恢复Cas酶活性。
由于光调控是一种非接触式手段,所有反应均可在单一试管内完成。实验结果显示,该光控系统的检测灵敏度比直接将Cas系统与扩增系统混合的方案高出两个数量级以上。
2、二代光控CRISPR技术
为进一步简化技术流程,研究团队开发了第二代光控方法,直接在引导RNA识别区修饰NPOM基团。
实验证实,当识别区内三个碱基被修饰时,引导RNA即失去活性,其机制是通过阻断识别氢键实现。该方法虽然更为直接,但仍存在靶标适用性和设计通用性的局限:NPOM基团仅能修饰T碱基,且三个修饰碱基需要保持特定间隔,这使得该方法对靶标序列有一定选择性。
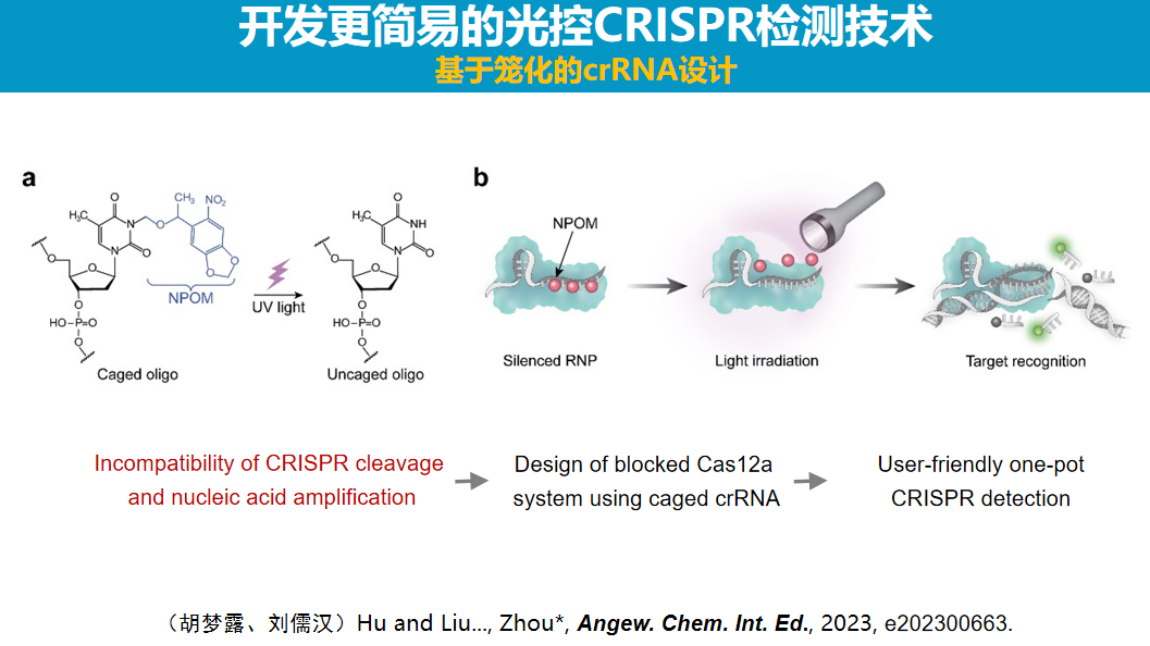
在性能方面,第二代方法与第一代相当。为支持该技术的应用,研究团队还专门研发了配套的光调控检测设备,填补了该领域专用设备的空白。这一系列工作为CRISPR诊断技术实现真正的一体化检测提供了新的技术路径。

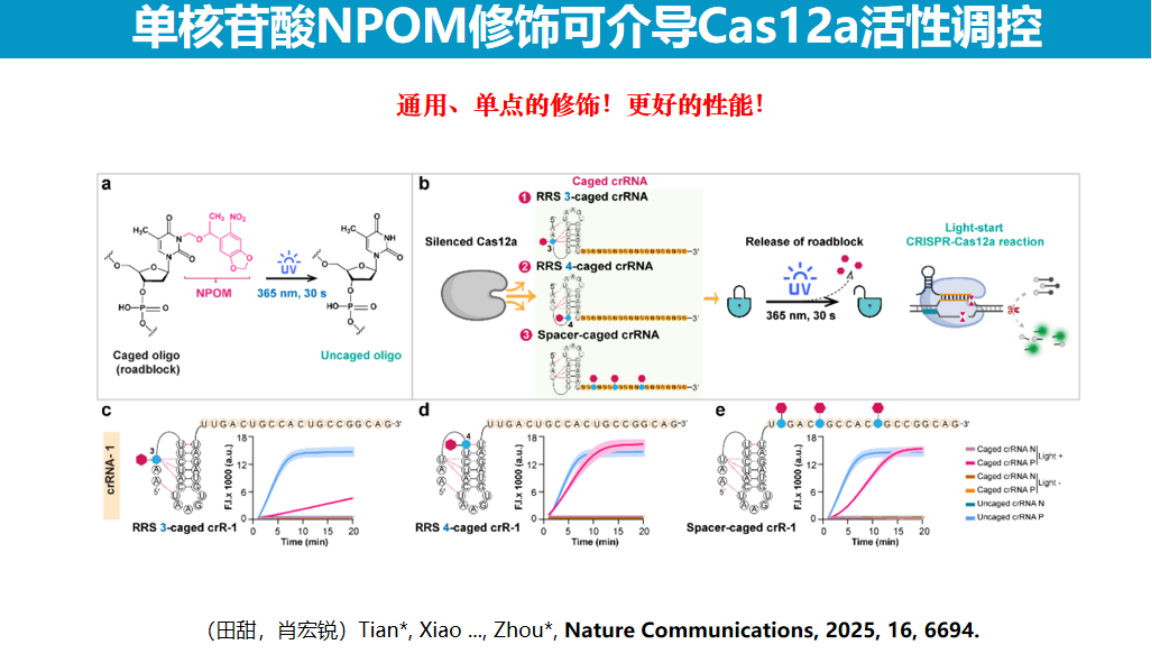
3、开发更通用的光控CRISPR技术
研究团队发现,在Cas12系统中,引导RNA前四个碱基对其活性具有关键影响。实验证实,当第3或第4位碱基发生突变时,Cas12引导RNA几乎完全丧失活性。基于这一发现,研究团队在这些关键位点引入NPOM光敏基团修饰,成功实现了引导RNA活性的光调控。

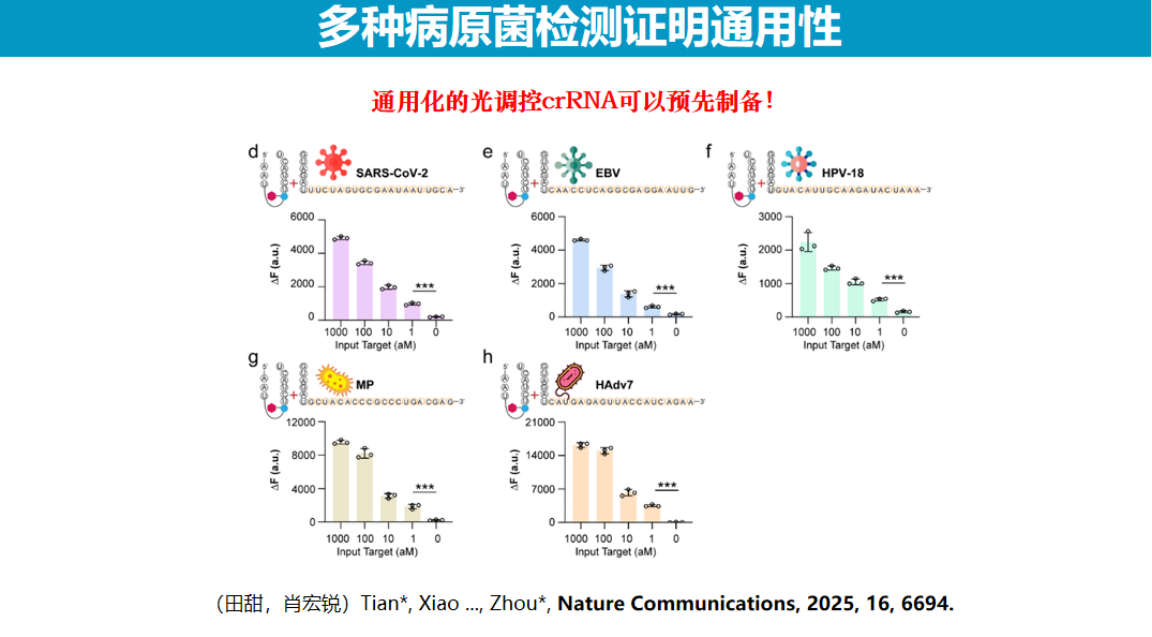
为提升该技术的通用性,研究团队采用了引导RNA拆分策略。
通过将引导RNA分为通用区和靶标特异性区两部分,仅需在通用区进行NPOM修饰,即可适用于不同靶标的检测。这种设计不仅简化了试剂制备流程,还显著降低了成本,因为通用区RNA可大规模合成,而靶标特异性区可根据检测需求灵活更换。
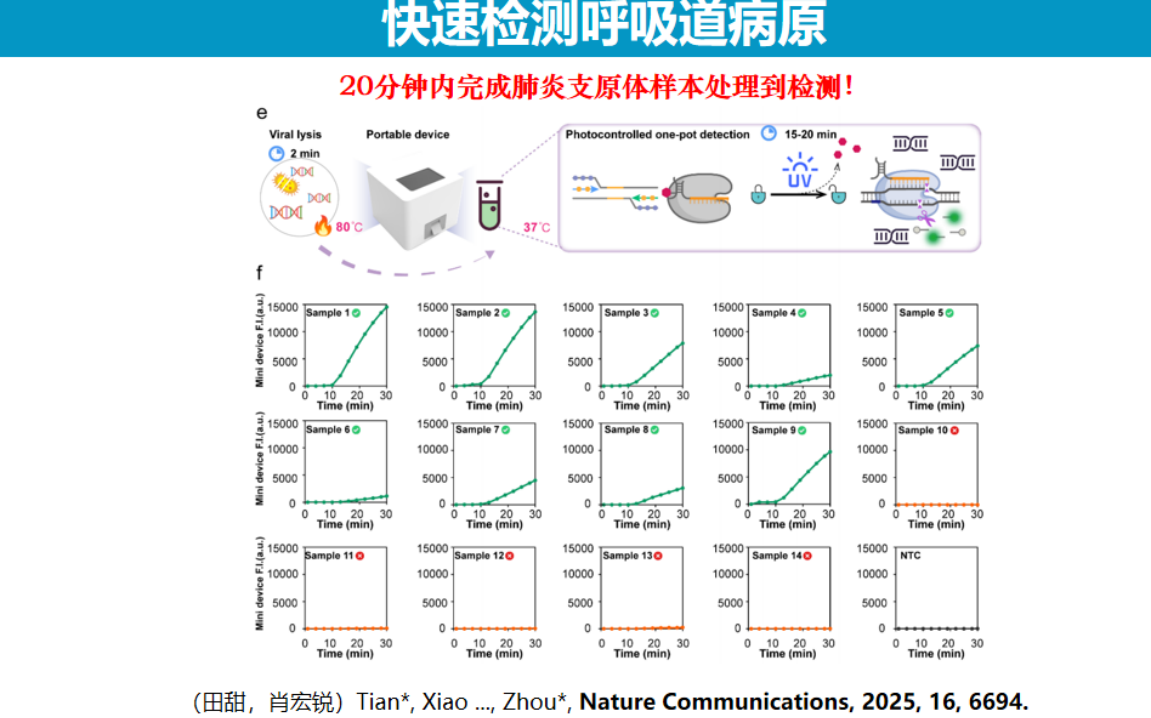
在应用方面,研究团队将该技术应用于儿科急诊中的肺炎支原体快速检测。通过优化样本前处理流程,采用直接裂解法替代传统核酸提取步骤,实现了从样本处理到检测完成仅需十几分钟的高效检测方案。
4、开发无PAM依赖的Cas12 光控检测
此外,研究团队还开发了一种创新方法来解决Cas12系统对PAM位点的依赖问题。
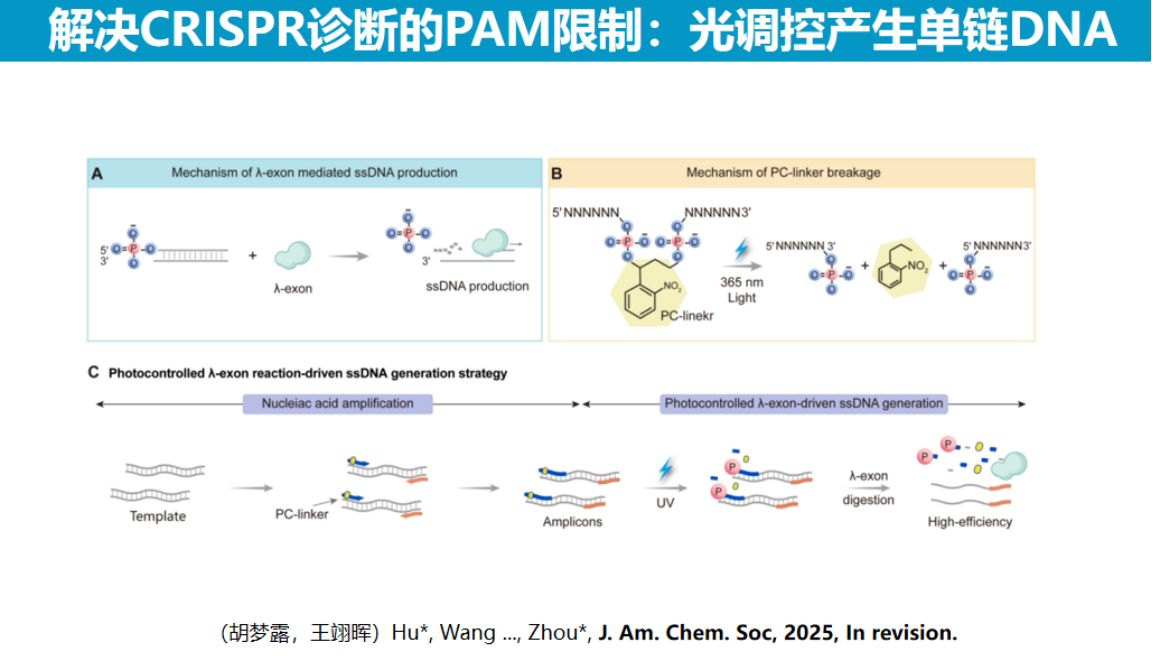
该方法利用λ外切酶的特性,通过光切割修饰引物暴露单链DNA的策略实现无PAM位点限制的检测。
具体而言,在扩增引物末端修饰可光切割的硝基苯基团,扩增产物经光照射后暴露出磷酸基团,随即被λ外切酶特异性切割释放单链DNA。
由于Cas12检测单链DNA无需PAM位点,该方法显著扩展了检测的通用性,特别适用于耐药基因检测和表观遗传位点分析等需要精确定位的检测场景。实验证实,该系统的反应速度与传统方法相当,且可在单一试管内完成全部操作。
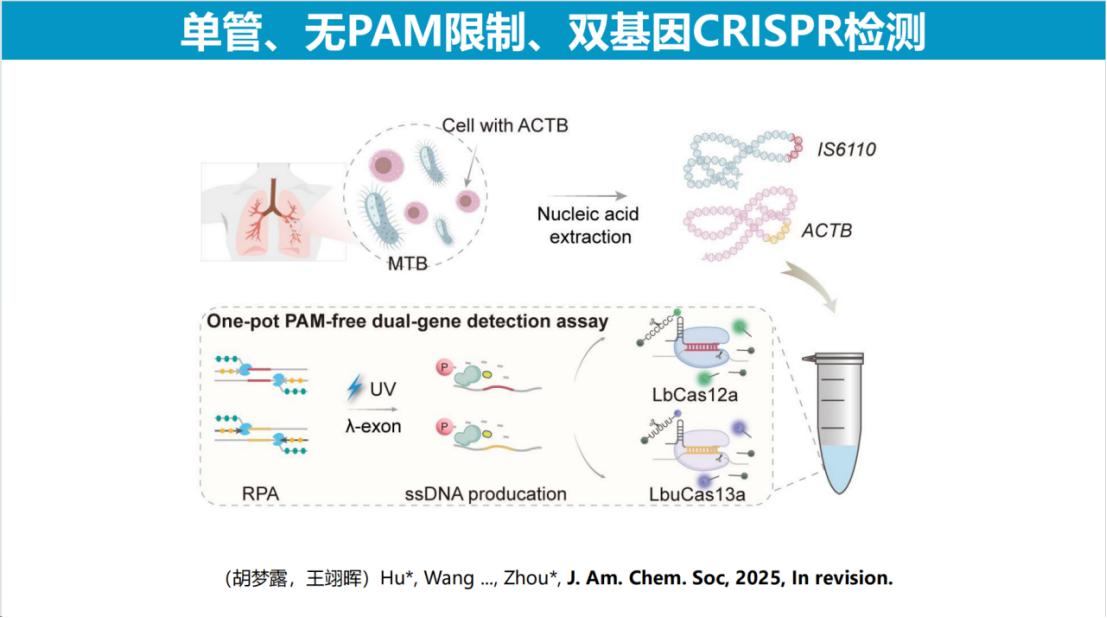
在单管双基因检测方面,研究团队利用Cas13和Cas12系统的协同作用,实现了结核杆菌检测中的靶标基因与内参基因同步检测。最新研究发现Cas13系统同样具备单链DNA检测能力,这一特性为构建单管多重检测系统提供了重要基础。相较于传统方法,该技术显著提升了检测系统的质控能力。
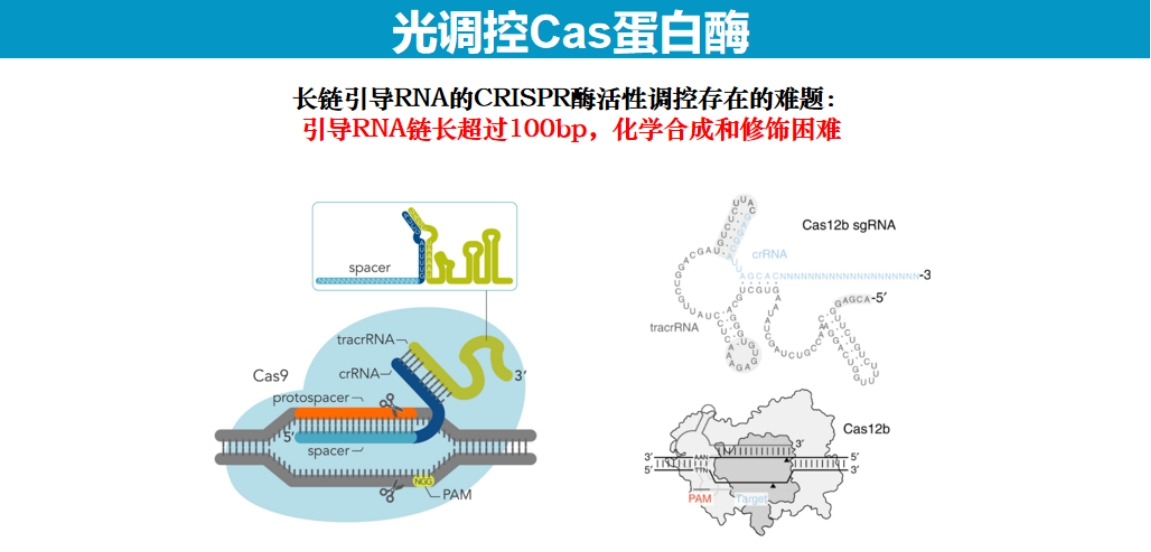
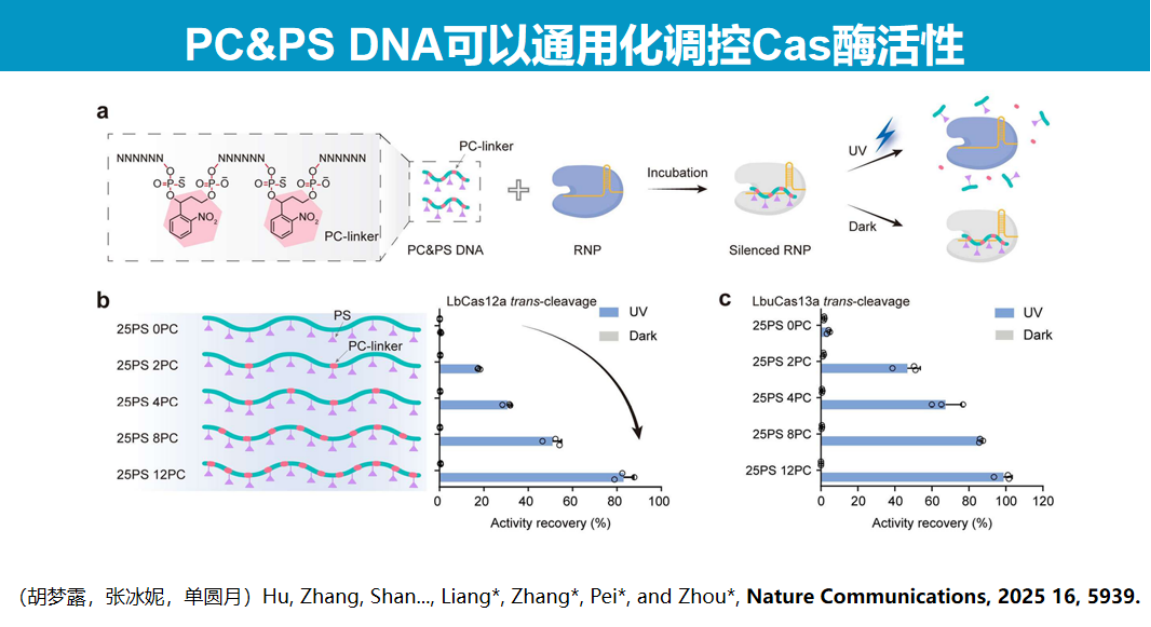
5、开发PC&PS DNA Cas酶活性调控策略
以上光调控工作主要通过调控引导RNA或DNA实现。而对于Cas12b及Cas9等系统,其引导RNA较长,难以通过化学修饰实现光调控。
为解决这一难题,研究团队创新性地采用PS DNA(硫代磷酸修饰DNA)调控策略。
研究团队在PS DNA上间隔修饰硝基苯基团(PC linker),通过光控断裂实现程序化调控。
实验证实,当PS DNA被光断裂至足够短时,Cas酶活性可恢复80%-90%。该调控机制类似于"捆绑效应",长链PS DNA通过空间位阻抑制酶活性,而短链PS DNA则失去抑制作用。
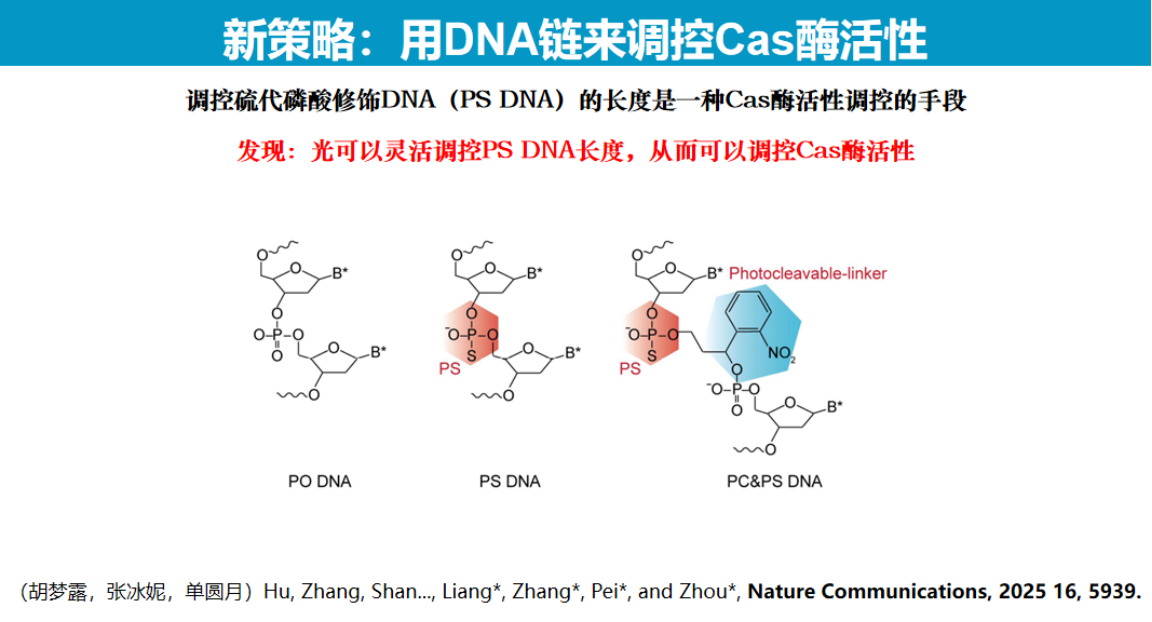
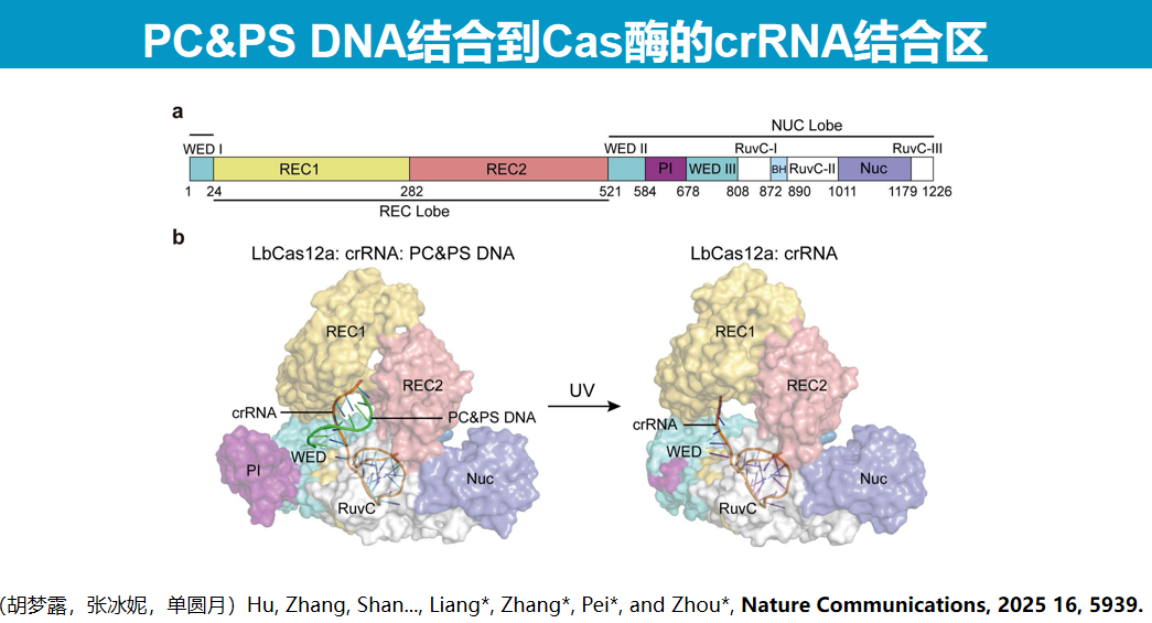
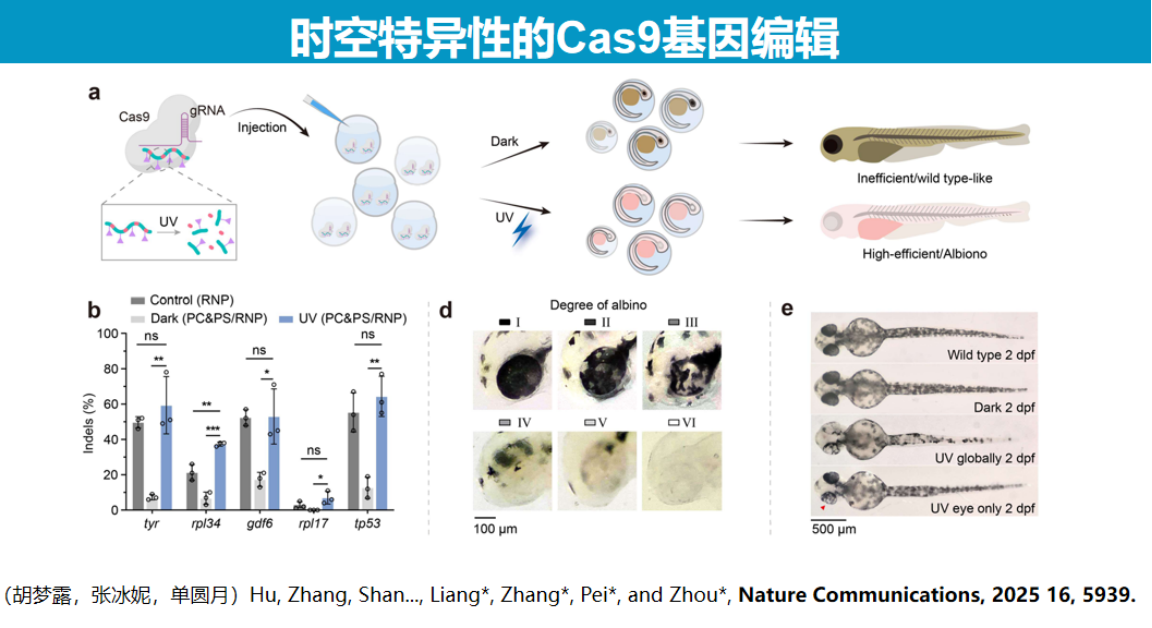
该技术具有广泛的适用性,可应用于Cas12b、Cas9及LbuCas13等多种核酸酶系统。冷冻电镜结构分析显示,UV照射后PS DNA完全从Cas13酶活性位点解离,酶结构恢复至原始状态。
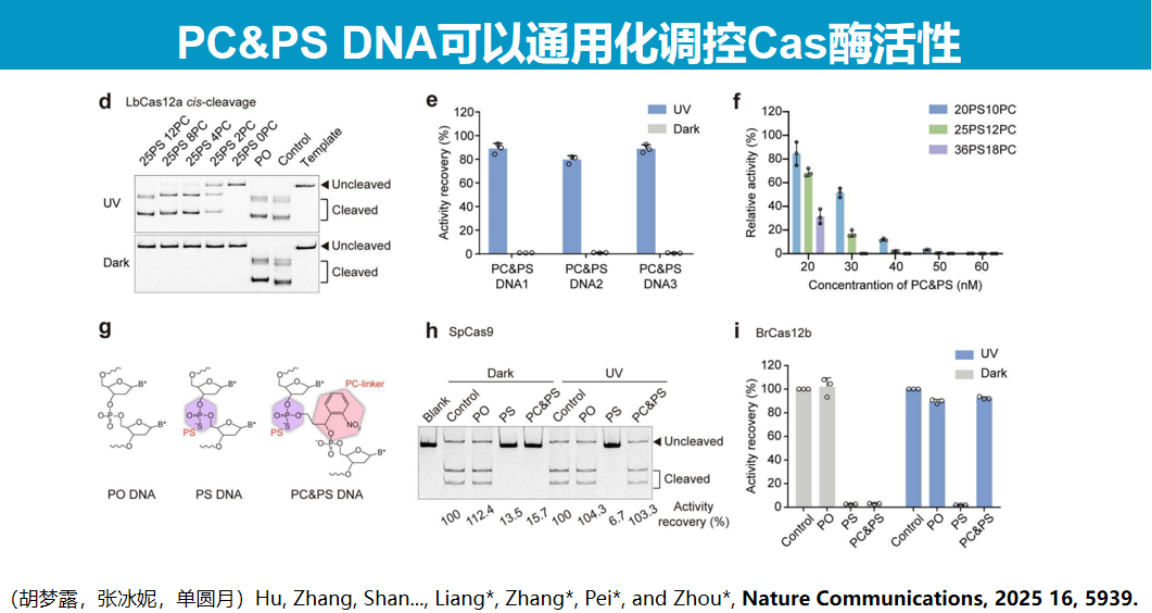
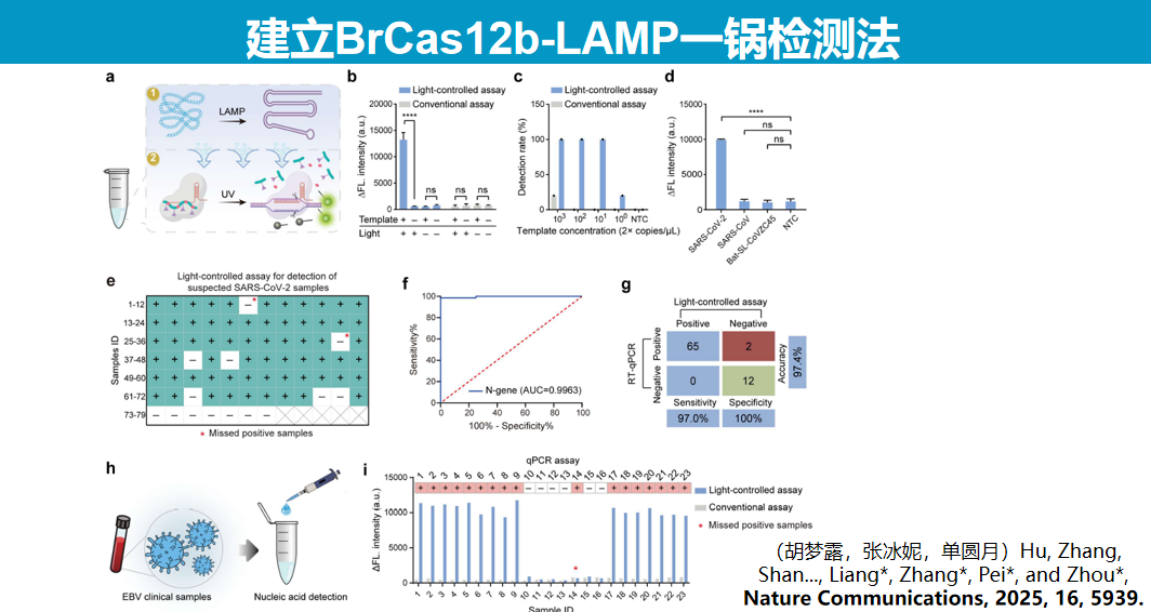
该技术展现出广泛的应用潜力。在分子诊断领域,结合LAMP等温扩增技术实现了Cas12b系统的一锅法检测;
在基因编辑领域,通过与Cas9系统联用,成功实现了斑马鱼眼部组织的时空特异性基因编辑,如选择性诱导单眼白化表型。
特别值得注意的是,该方法理论上适用于各类核酸酶(包括外切酶、内切酶和聚合酶)的活性调控,为CRISPR技术的精准控制提供了通用解决方案。
本研究团队在数字化CRISPR检测领域开展了初步探索工作。
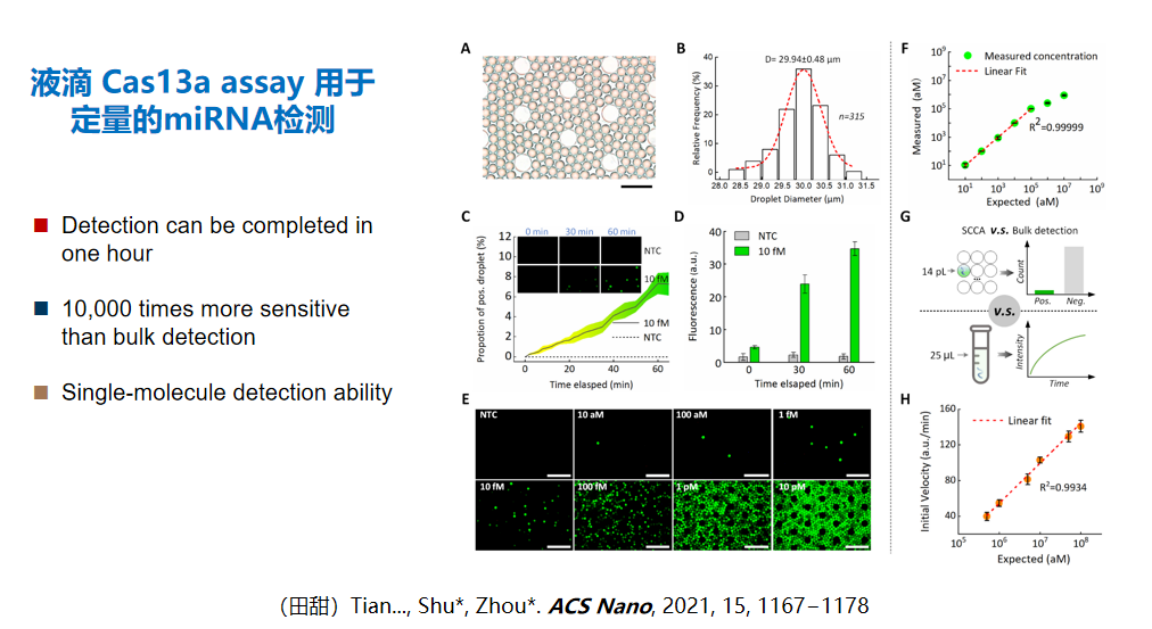
传统单分子检测技术(如纳米孔、单分子光伏或单分子电化学)面临分子扩散效率限制,需要较高体系浓度才能实现有效检测。针对这一技术瓶颈,我们创新性地采用微缩反应体系的方法,将传统微升级反应体系分割为皮升级液滴,利用限域效应显著提升局部浓度。

理论计算表明,单个分子在皮升体积中的局部浓度可达10-12摩尔,这一浓度水平已进入CRISPR系统的可检测范围。
实验证实,通过将CRISPR试剂分配至皮升液滴中,确实能够实现单分子水平的检测。该方法从原理上属于绝对定量技术,无需依赖核酸扩增过程,未来在体液病毒载量检测等领域具有重要应用价值。
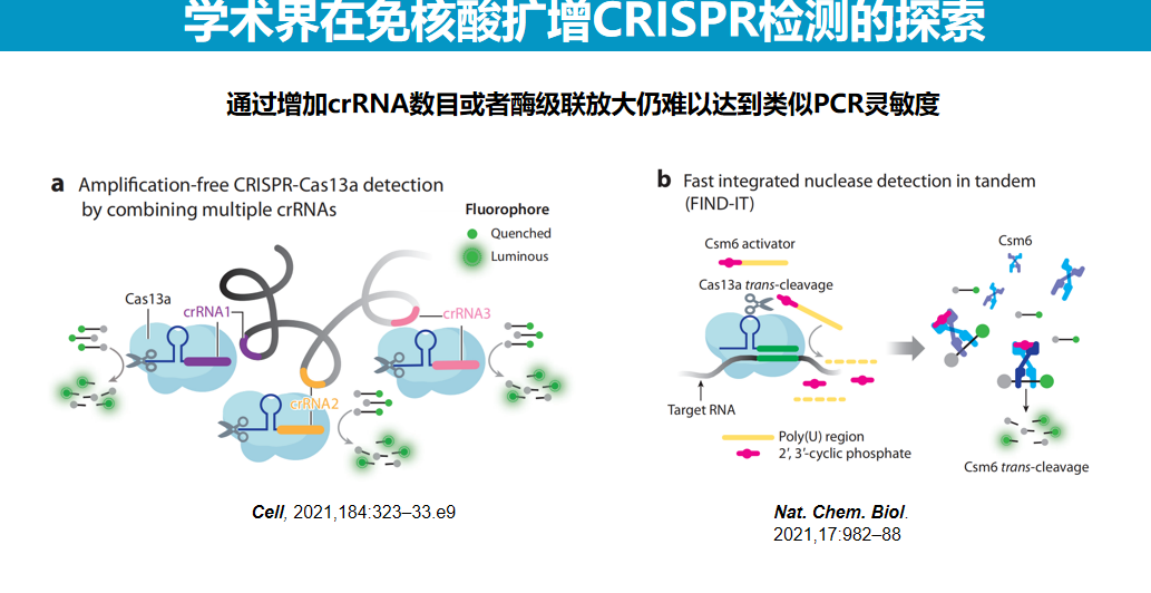
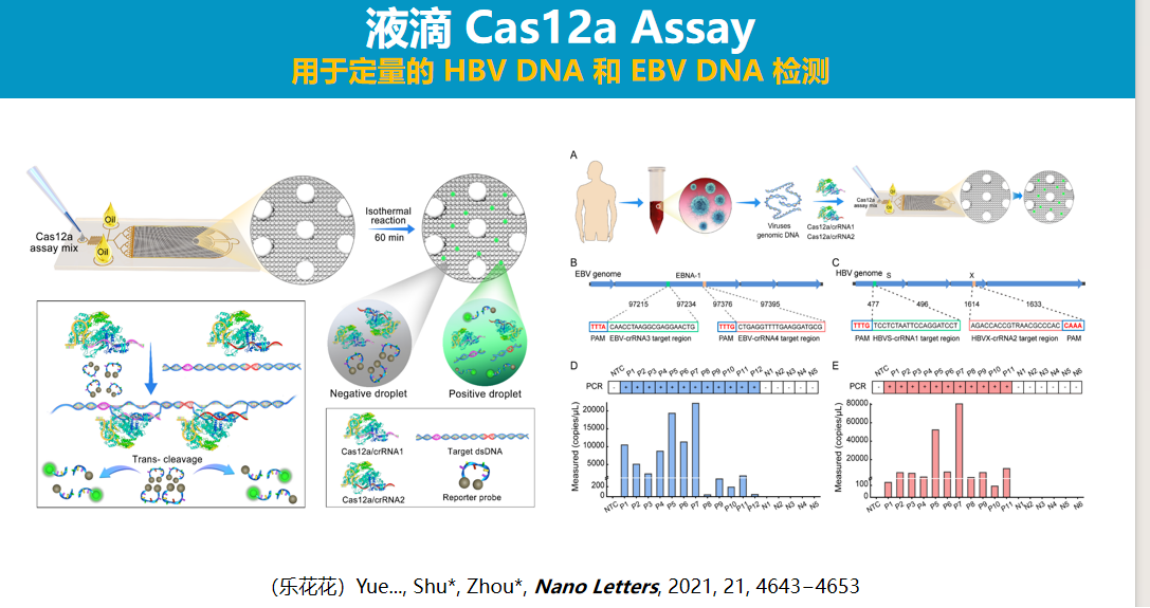
目前CRISPR诊断技术已在定性、半定量及定量检测方面取得显著进展,部分性能指标已超越传统技术限制。
然而仍需持续优化以推动实际临床应用。本团队工作为CRISPR诊断技术的进一步发展奠定了重要基础。未来将继续深耕该领域,致力于开发更具实用价值的检测方法。






发表评论 取消回复