本期分享淮北师范大学张珊珊博士报告:《基于CRISPR的非核酸靶标检测》。


2025年8月2日,由中国医药生物技术协会生物诊断技术分会主办,第二期生物诊断前沿技术专题会在江苏省无锡市惠山生命科技园召开。专题会聚焦CRISPR免扩增与非核酸检测技术。
生物诊断公众号将对各专家汇报内容进行汇编整理,供关注CRISPR诊断技术的业内同仁学习参考。
本期分享淮北师范大学张珊珊博士报告:《基于CRISPR的非核酸靶标检测》。

张珊珊,博士。2021年毕业于南京林业大学化学工程学院,获得工学博士学位。2023年至今,为安徽农业大学、淮北师范大学、吐露港生物联合培养博士后。博后主要研究方向为“基于CRISPR的非核酸靶标检测”。至今共发表SCI论文6篇,专利2项。
以下为张珊珊博士的部分报告内容:
注:报告由生物诊断平台整理汇编,内容仅供学习参考
非核酸靶标检测在临床诊断、食品安全、环境监测及生命科学等领域具有广泛应用价值。
然而,传统检测方法如高效液相色谱法(HPLC)、气相色谱法(GC)、质谱法(MS)和酶联免疫吸附法(ELISA)等,普遍存在局限性。这些方法高度依赖大型仪器或专业操作人员,检测成本较高,难以满足即时检测(Point-of-Care Testing, POCT)、便捷检测及现场检测等实际需求。
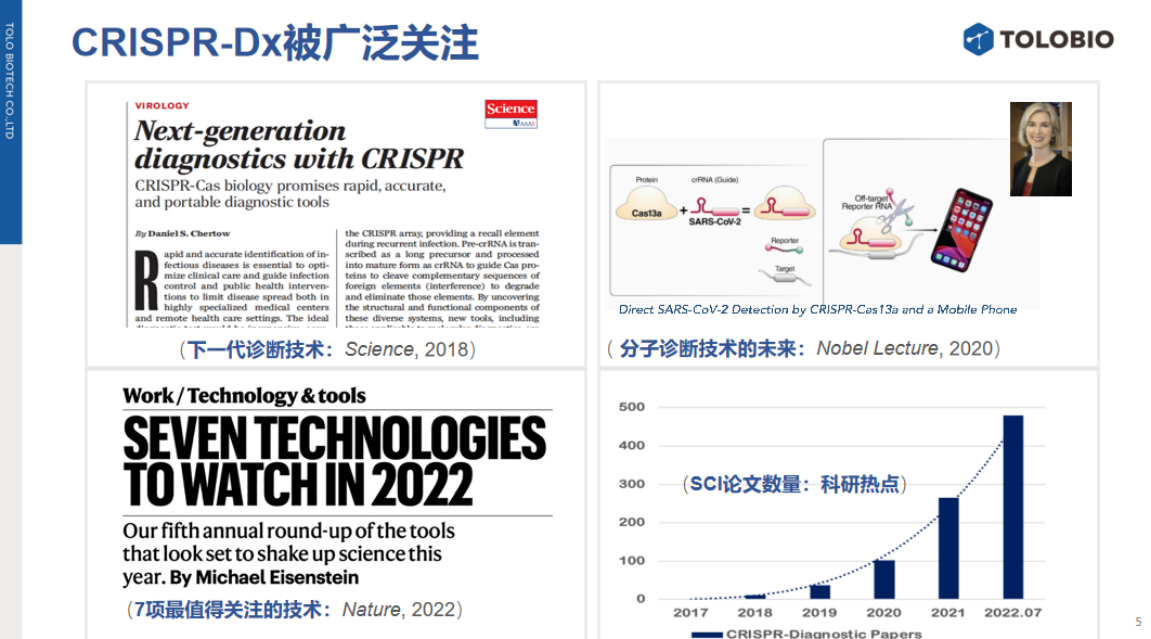
CRISPR/Cas技术的问世,为解决上述问题提供了创新性解决方案。
CRISPR技术自2012年Cas9作用机制解析以来发展迅速,并于2020年获诺贝尔化学奖,其在基因编辑领域已取得重大突破。
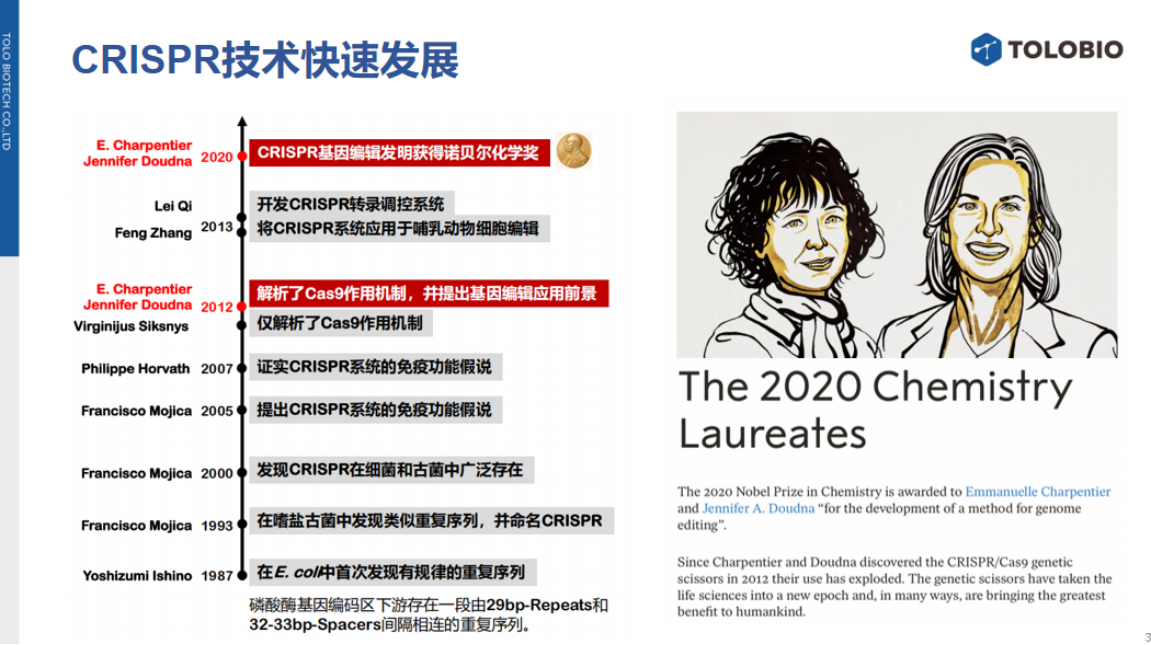
尽管CRISPR诊断技术起步较晚,但其发展速度迅猛,已在科研与产业领域获得广泛关注。
目前,该技术主要集中于核酸靶标检测。从方法学核心分析,核酸靶标的识别依赖于Cas蛋白固有特性——Cas效应器与gRNA形成核糖核蛋白复合物(RNP)后,可直接结合靶标核酸形成三元复合物。与靶标核酸结合后,Cas蛋白可通过反式切割对报告探针进行非特异性切割,释放荧光信号。
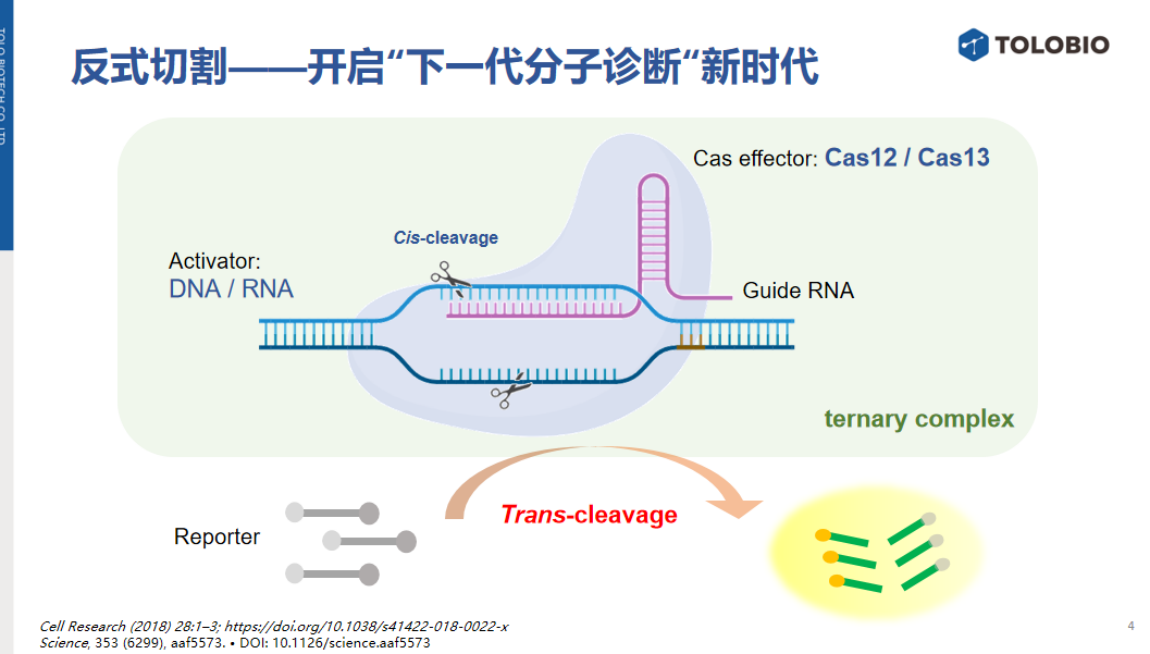
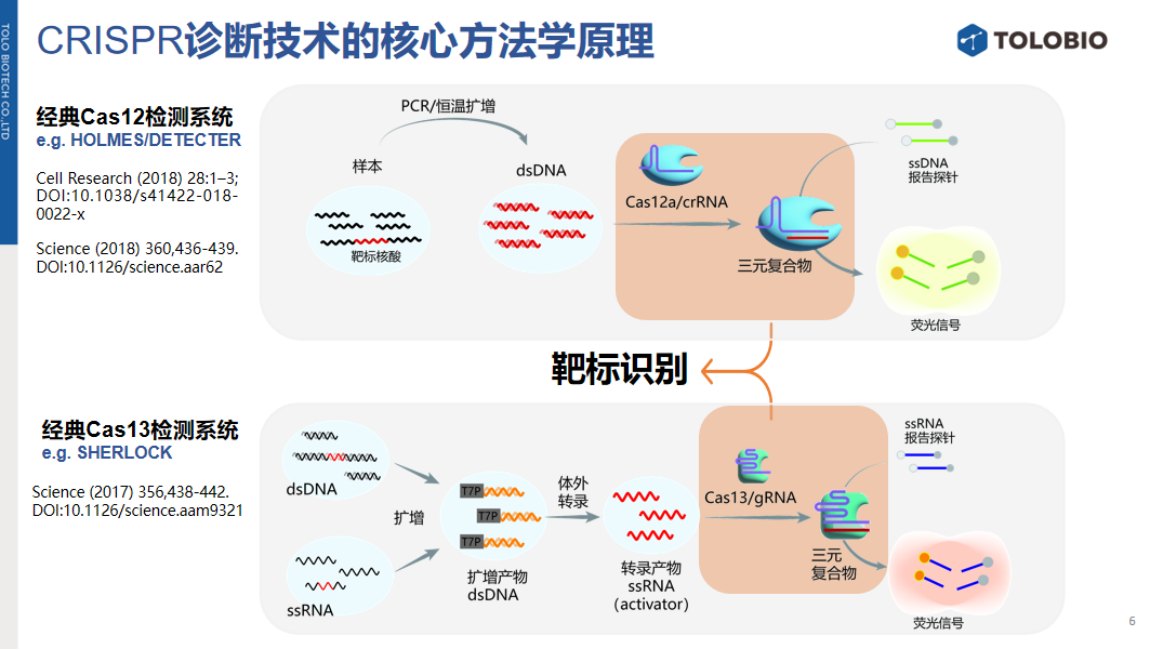
然而,对于非核酸靶标(如离子、小分子或蛋白质),Cas蛋白无法直接识别。因此,非核酸靶标检测需解决两个关键模块:首先,从样本中特异性识别目标靶标;其次,将识别信号转化为可触发CRISPR信号放大与输出的机制。
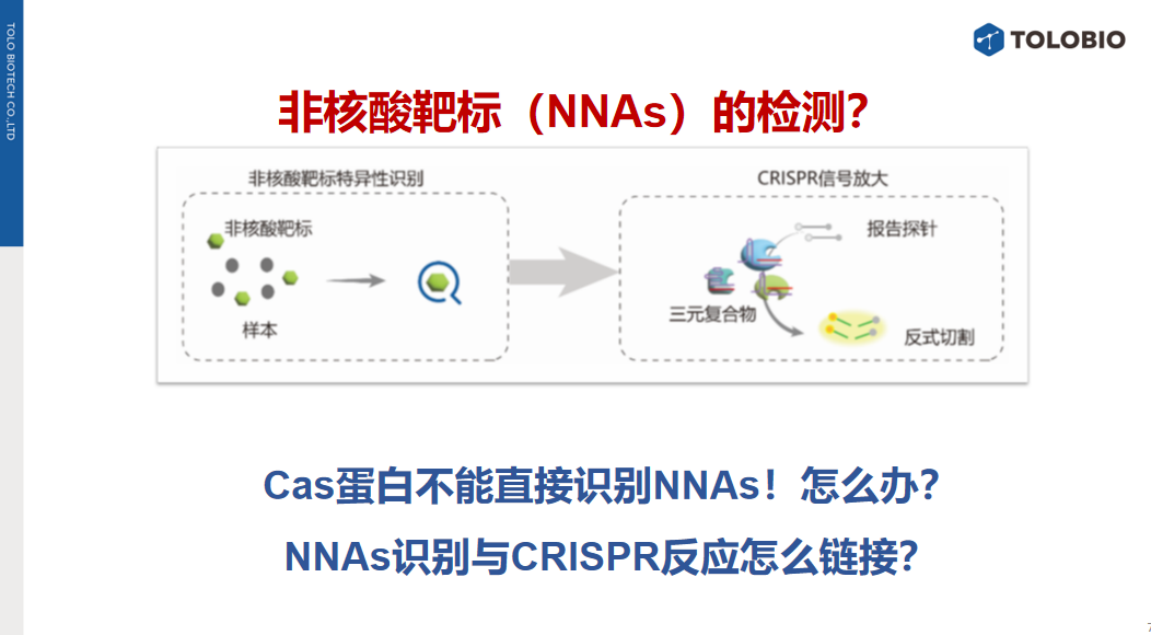
由于Cas蛋白无法直接识别非核酸靶标,需建立非核酸靶标识别信号与CRISPR反应之间的桥梁机制。
CRISPR诊断的核心技术依赖于反式切割活性,其必要条件是Cas效应器、向导RNA(gRNA)和靶标激活序列(activator)形成三元复合物。因此,调控反式切割活性可通过干预这三个元件实现,从而为NNAs检测提供思路。
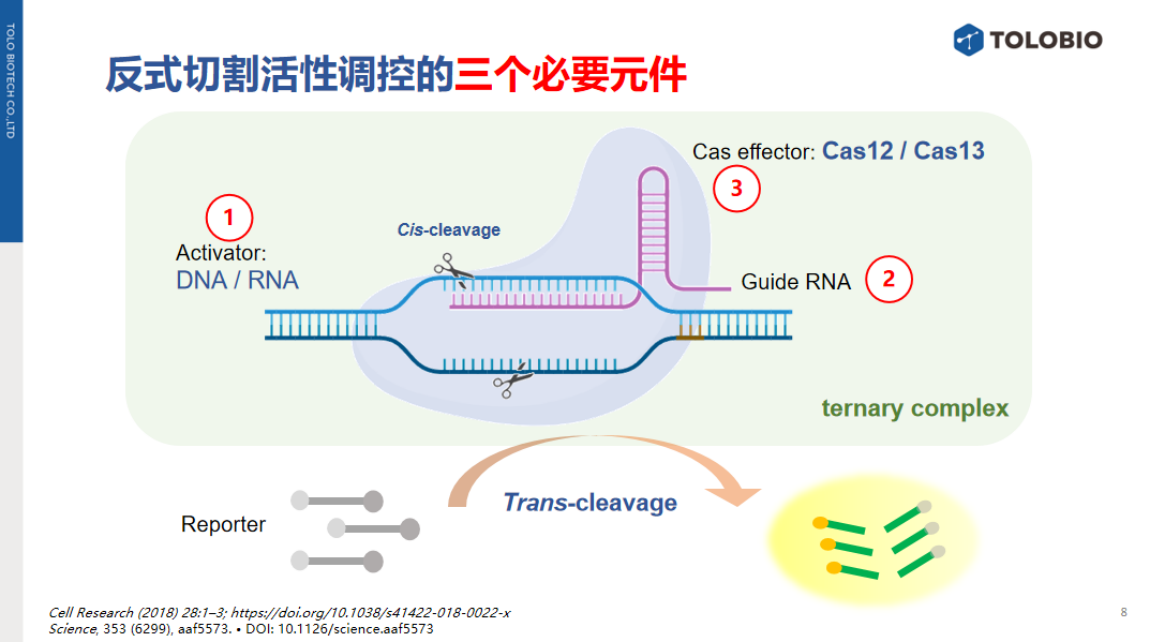
在基于activator的调控策略中,根据与非核酸靶标直接作用的元件类型,可进一步细分为五种子类。
1、适配体介导的activator调控
适配体(Aptamer)介导的方法最为经典。适配体为短链寡核苷酸,可与特定小分子或靶标结合后发生构象变化,广泛应用于NNAs检测。其设计主要包括三种模式:
适配体可作为"锁定链"(locker),通过互补配对阻断activator序列。当非核酸靶标与适配体结合后,释放游离的activator,激活Cas反式切割活性(signal-on模式)。
适配体可作为"连接桥"(linker),将activator固定于载体表面。当靶标结合适配体时,activator从载体释放,触发反式切割活性。
适配体可直接作为activator。当适配体与NNA靶标结合后,便不能激活Cas12a蛋白的反式切割活性,导致信号的降低。(signal-off模式)
2、DNAzyme介导的activator调控
DNAzyme(脱氧核酶)广泛用于金属离子靶标检测。
此类系统通常包含三个关键模块:DNAzyme、被阻断的activator序列以及DNAzyme的特异性切割位点。当靶标金属离子(如Pb²⁺、Na⁺)激活DNAzyme时,其在切割位点进行水解,释放游离activator,进而触发Cas反式切割活性。
除金属离子外,DNAzyme还可响应其他非核酸靶标。例如,在葡萄糖检测系统中,葡萄糖氧化酶首先将葡萄糖转化为过氧化氢,随后过氧化氢诱导设计为“手枪状”结构的DNAzyme发生自切割,最终释放activator并输出信号。
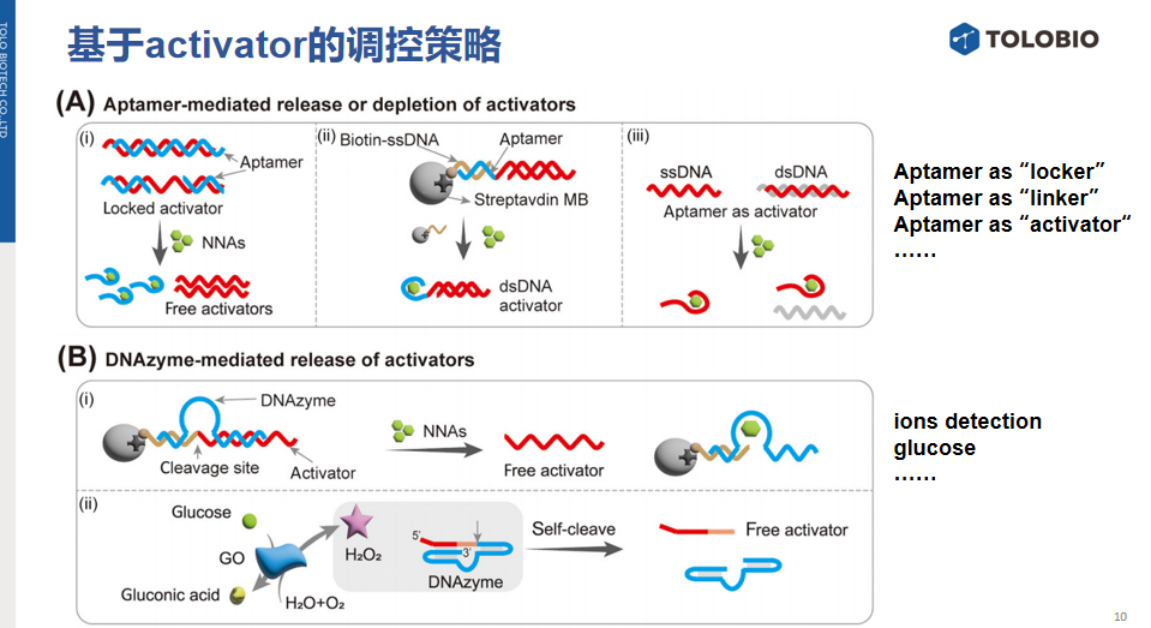
3、变构转录因子(aTF)介导的activator调控
该策略的代表性案例为CaT-Smelor系统。
其核心机制在于:固定化的aTF预先捕获activator,当靶标非核酸分子存在时,其与activator竞争结合aTF,导致activator释放并激活Cas反式切割活性。
类似aTF的作用原理也可拓展至其他靶标检测,例如通过对activator进行小分子修饰,当靶标蛋白或结合物存在时,在activator表面形成空间位阻,阻碍其激活功能(signal-off模式)。
4、吸附策略介导的activator调控
基于固定化载体的吸附策略利用抗体-抗原特异性结合调控activator。例如,将activator通过抗体固定于载体表面,靶标存在时通过竞争反应释放activator。
该策略亦可采用适配体替代抗体作为捕获分子:适配体与固定化载体结合后捕获activator,当靶标离子存在时,适配体构象变化导致activator释放,进入后续CRISPR反应体系。
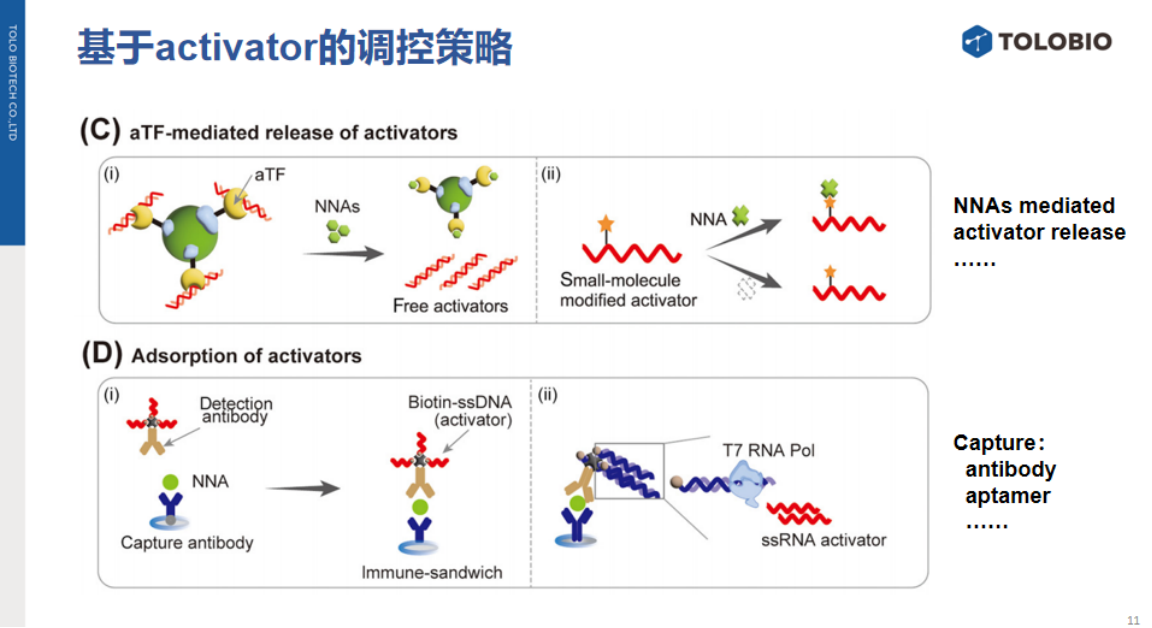
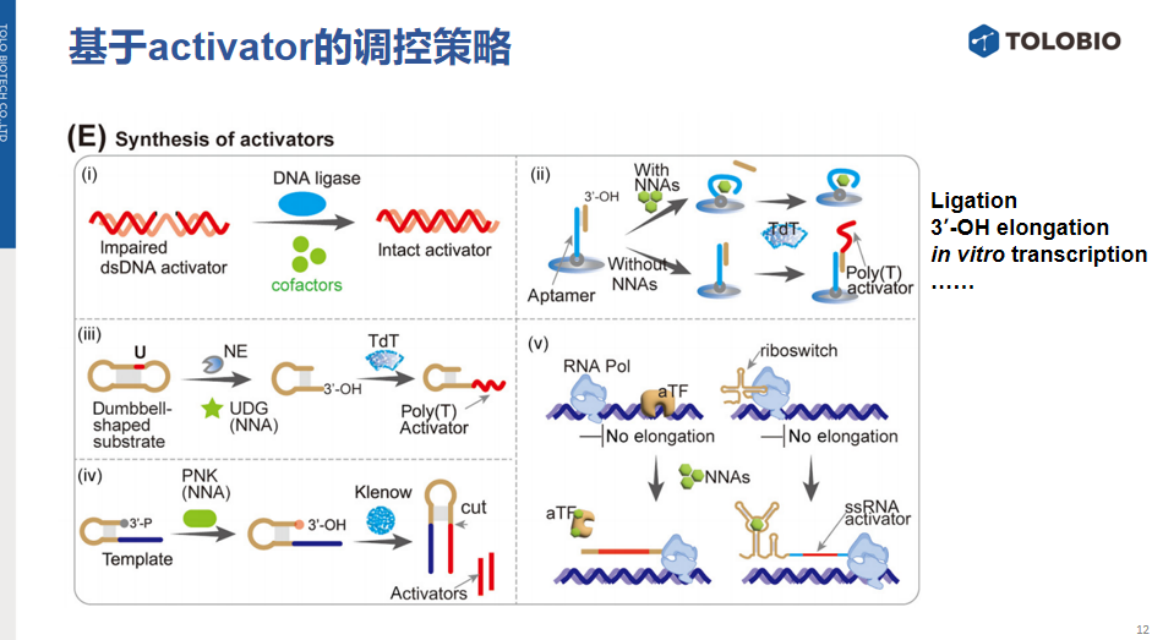
5、合成activator的调控策略
此类策略依赖分子工具酶合成或重构activator,主要分为三类:
①DNA连接酶介导的修复:设计含缺口的双链activator,当靶标辅因子(如NAD⁺/ATP)存在时,激活DNA连接酶活性,修复缺口形成完整双链activator,触发反式切割活性。
②3'-OH延伸介导的生成:利用末端脱氧核苷酸转移酶(TdT)、端粒酶或Klenow DNA聚合酶等,在模板引导下延伸3'-OH端合成activator。例如:TdT酶催化添加PolyT尾激活反式切割;链置换扩增(SDA)或多核苷酸激酶(PNK)介导生成单链activator。
③aTF调控体外转录:适用于Cas13系统(需RNA activator)。通过变构转录因子(aTF)或核糖开关响应靶标:当靶标结合aTF时解除转录抑制,启动体外转录生成单链RNA(ssRNA)activator,激活Cas13反式切割活性。
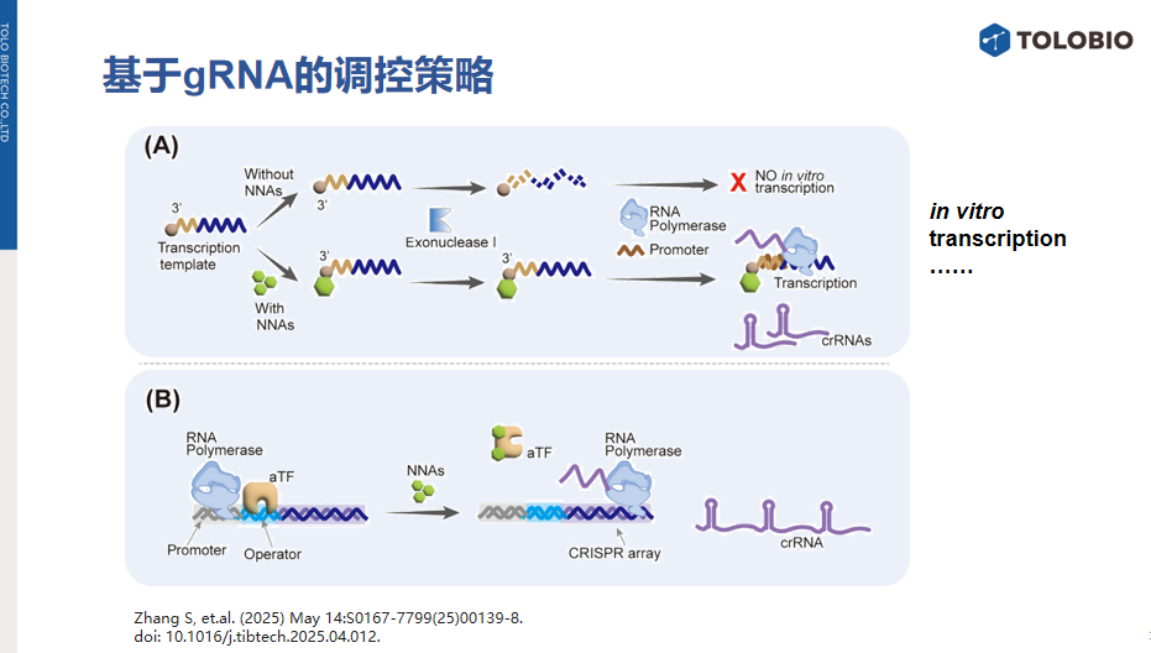
该策略通过调控crRNA合成实现信号转换,相关研究包括:
1、外切酶辅助的模板保护:在crRNA转录模板的3'端修饰小分子。当非核酸靶标存在时,与模板结合形成空间位阻,抵御外切酶I(ExoI)切割,保留模板并启动IVT生成功能性crRNA(signal-on模式)。(图A)
2、aTF调控的转录启动:在T7启动子与CRISPR阵列间设计aTF结合区。当靶标存在时aTF解离,启动IVT合成crRNA。(图B)
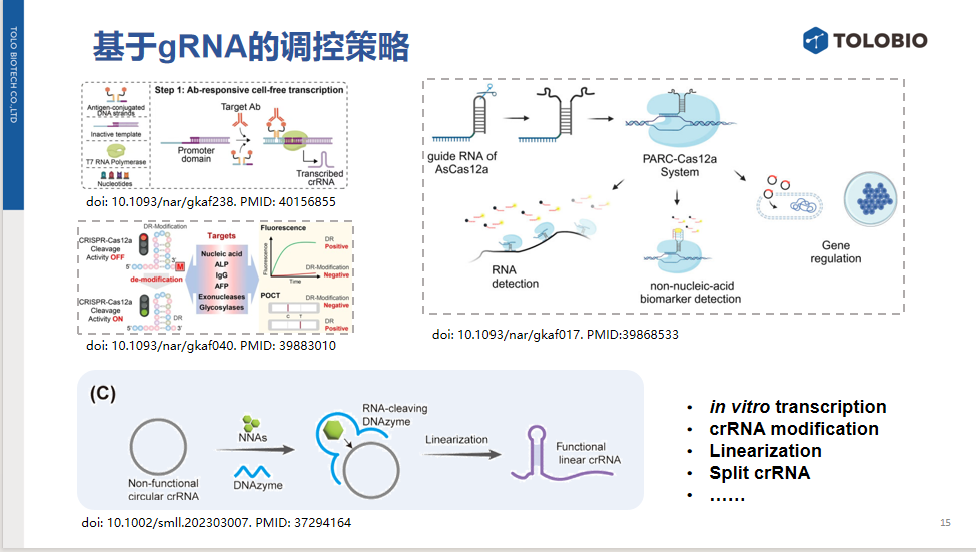
3、用于抗体检测的转录调控:当目标抗体存在时,可形成体外转录完整体系,启动crRNA的转录。
4、基于crRNA修饰的调控策略:在crRNA 3'端设计可解除的修饰,靶标存在时释放抑制活性。
5、基于crRNA拆分与组装策略:gRNA可在特定位点被拆分为两个片段,导致CRISPR活性暂时丧失。但这些片段能通过核酸杂交、小分子或适配体相互作用等外部方式重新组装,恢复CRISPR–Cas12a功能。从而可设计针对小分子的检测系统。
6、基于环状crRNA的检测策略:设计一种非功能性的环状crRNA,其本身无法启动反式切割活性;同时利用具有RNA切割活性的核酸酶,在存在非核酸靶标时,在特定切割位点将环状crRNA线性化,从而形成具有功能性的线性crRNA,最终激活反式切割活性。(图C)

上述两类策略(activator与crRNA调控)均需将非核酸靶标信号转换为核酸信号,其设计存在固有局限性。为此,通过直接调控Cas效应器活性的策略开辟了新路径。
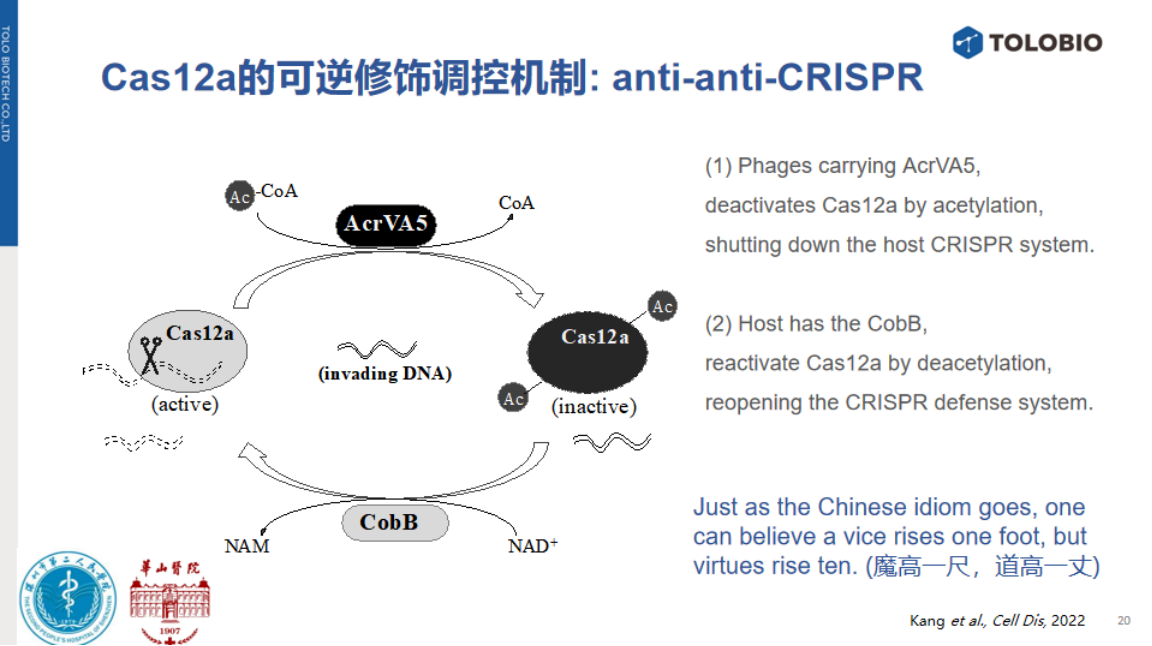
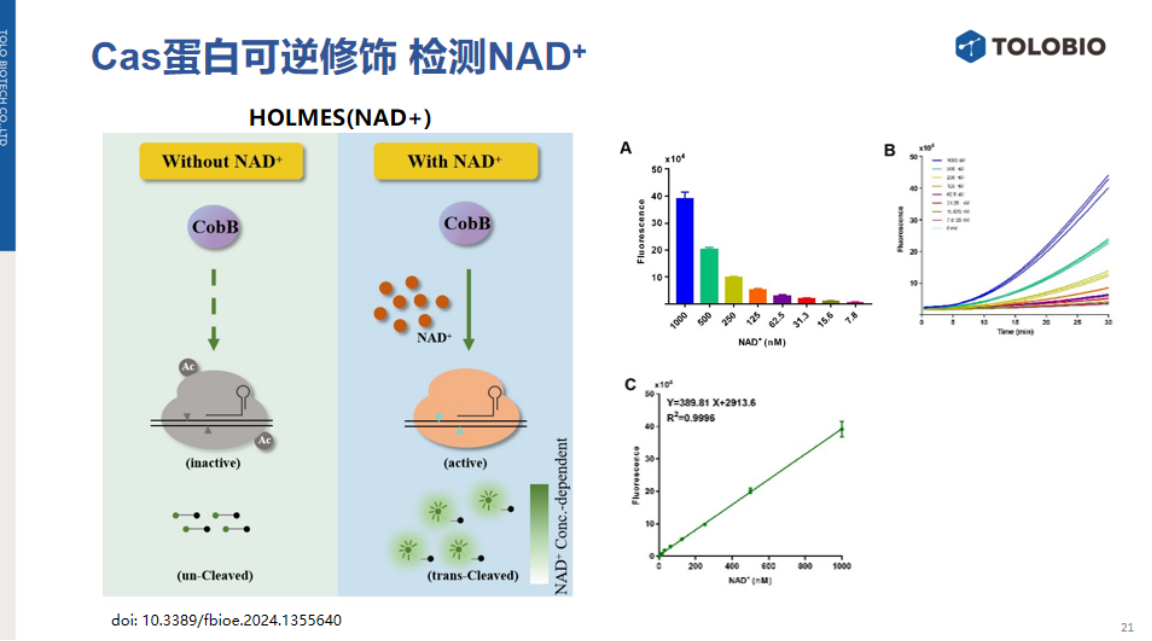
1、基于NNA靶标的乙酰化-去乙酰化修饰机制进行NNA检测
病毒来源的乙酰转移酶可乙酰化修饰Cas12a,使其丧失顺式与反式切割活性;而细菌脱乙酰酶CobB能以NAD⁺为辅因子,逆转该修饰并恢复Cas12a活性。基于此原理可开发以下两种非核酸检测系统:
NAD⁺检测系统:在NAD⁺存在时,可激活CobB去乙酰化作用,恢复Cas12a反式切割活性并输出信号;
去乙酰化酶活性检测:乙酰化的Cas12a也可以被用于直接检测待测体系中去乙酰酶的活性。活性越高,检测信号越强。

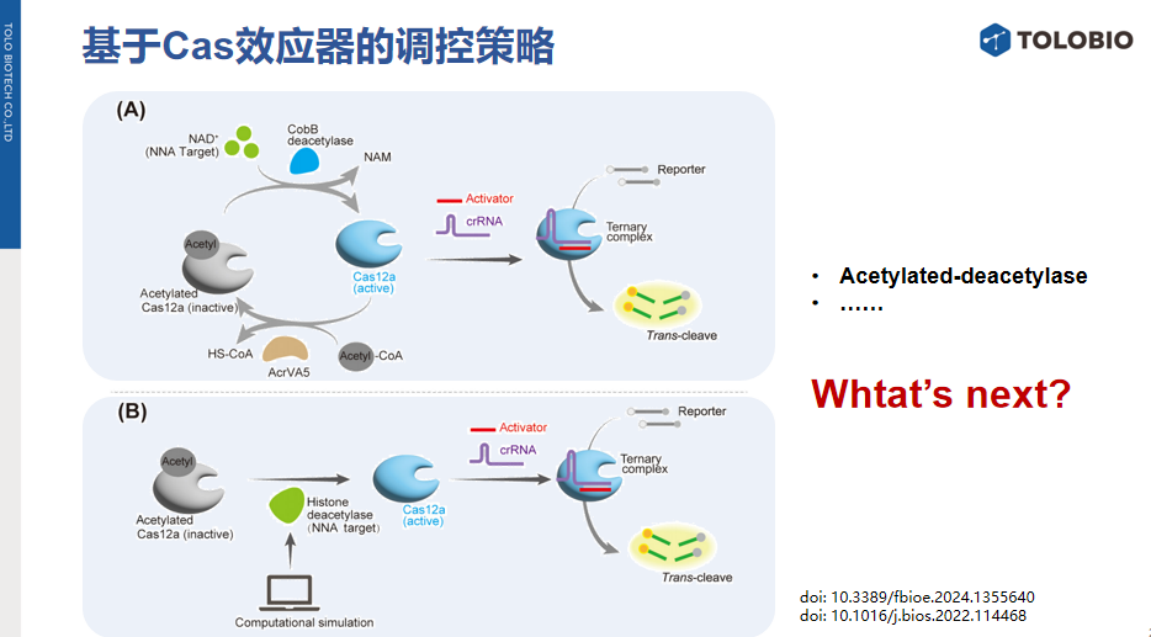
2、突破Cas蛋白直接识别限制的探索:
传统认知中,Cas蛋白无法直接识别非核酸靶标。为打破这一限制,国内已有团队(如吐露港生物)正在探索Cas效应器与非核酸靶标的直接互作机制,旨在开发无需信号转换的新型检测系统。
体内检测非核酸生物标志物对临床早期疾病筛查、靶向治疗指导、动态监测及毒性预警具有重要意义。当前代表性工作包括:
1、刺激响应型Cas12a传感系统:基于PAM-less DNA底物设计,结合适配体实现活细胞内靶标动态监测。建立了以下两种检测策略:
端粒酶检测:截短型PAM-less DNA作为底物,当端粒酶存在时,可补全activator,激活Cas12a反式切割;
ATP浓度检测:适配体可阻断activator,当ATP存在时,可与适配体结合释放activator,启动CRISPR检测。
2、多重癌症标志物尿液检测平台:
为监测癌症相关蛋白酶活性。可将硫代磷酸修饰的DNA条形码通过蛋白酶敏感多肽连接至纳米抗体,静脉注射后,目标蛋白酶切割多肽链释放条形码。释放的DNA条形码经肾脏滤过进入尿液,通过Cas12a激活荧光信号,其强度与蛋白酶活性呈正相关。
将不同蛋白酶敏感多肽与特异性条形码偶联于聚合物纳米载体,可同时监测多种癌症相关蛋白酶活性。
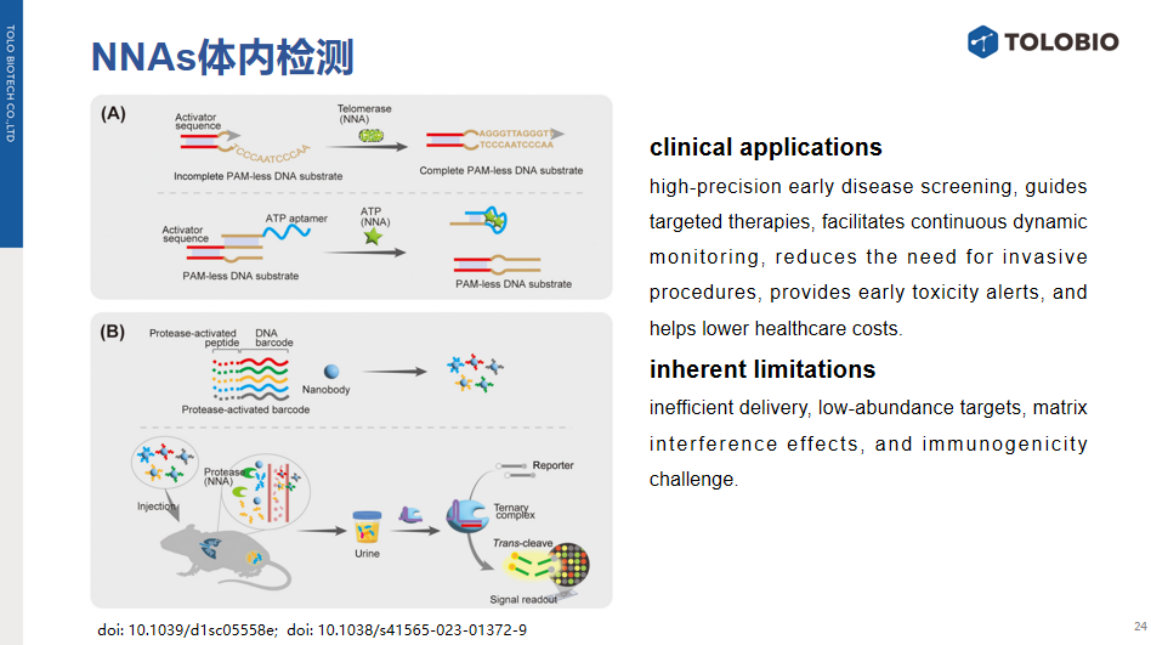
目前非核酸靶标体内检测仍面临递送效率、低丰度靶标富集、基质干扰效应、免疫原性及稳定性等关键问题。
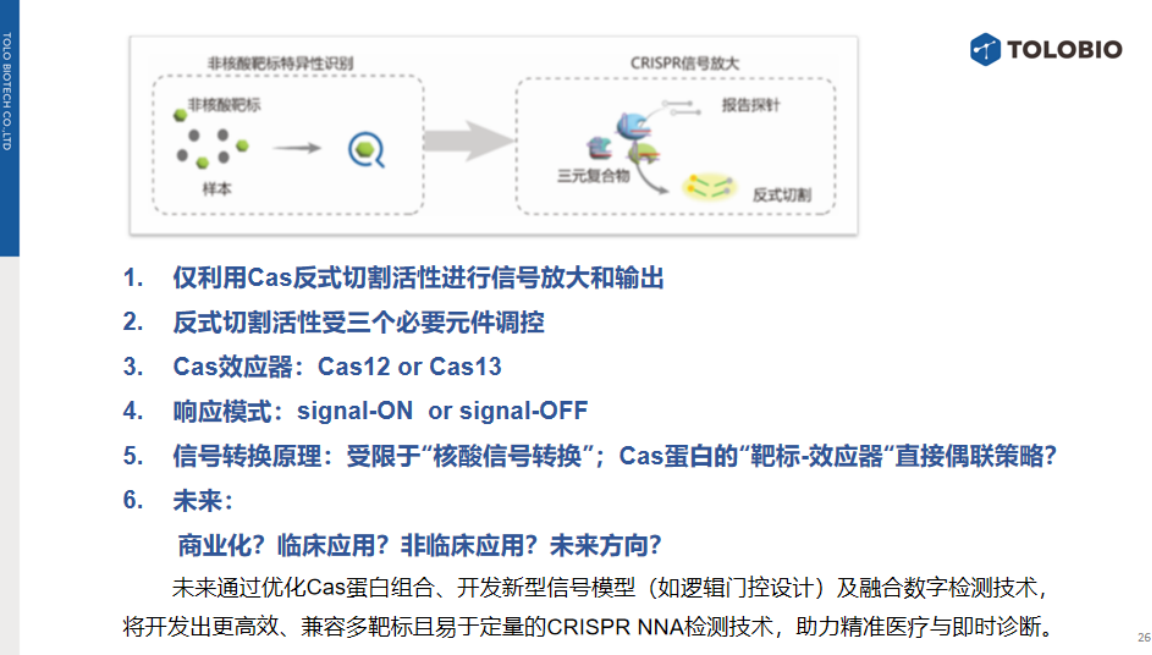
CRISPR非核酸靶标检测策略可分为三类:游离activator调控(主流策略)、crRNA生成调控及Cas效应器活性重构调控。
在效应器的选择上:Cas12a系统应用最广,其优势在于:依赖短链crRNA与ssDNA报告探针;DNA activator稳定性优于Cas13的RNA activator。
在信号模式设计上,signal-on模式占主导(灵敏度与稳定性更优),signal-off模式面临更大技术挑战。
当前非核酸靶标检测策略仍需将非核酸信号转换为核酸信号,而Cas蛋白直接识别非核酸靶标的机制尚未突破。
未来可通过优化Cas蛋白组合、设计逻辑门控信号模型及融合数字检测技术(如微流控、单分子计数),开发更高效稳定的CRISPR非核酸靶标检测技术。从而助力非核酸靶标的及时诊断、食品安全快速检测等领域的不断进步。





发表评论 取消回复